T.P. 6 Préparation de solution de sulfate de cuivre par dissolution
Objectifs :
¤
savoir préparer des solutions de concentrations données par dissolution
d’un solide,
¤ utiliser l’échelle de
teintes constituée pour déterminer la concentration molaire inconnue d’une
solution.
I] Principe
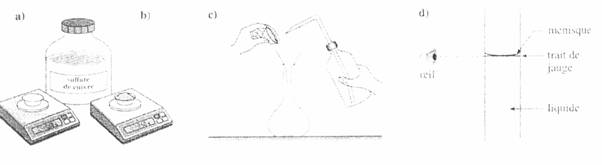
Pour
préparer une solution par dissolution d’un solide, il faut :
1) Peser la masse désirée de soluté avec une balance
électronique.
2) Introduire un peu d’eau distillée dans une fiole
jaugée de la capacité désirée.
3) Y introduire, à l’aide d’un entonnoir,
le solide pesé.
4) Rincer la coupelle et l’entonnoir en
faisant couler les eaux de rinçage dans la fiole jaugée.
5) Remplir la fiole aux ¾ avec de l’eau
distillée, boucher et agiter.
6) Compléter jusqu’au trait de jauge (qui doit
être confondu avec le bas du ménisque) avec de l’eau distillée,
boucher et homogénéiser.
II] Protocole expérimental
1)
Fabrication des solutions
1) On désire préparer 50 mL d’une solution de
sulfate de cuivre à 0,50 mol.L-1. Quelle quantité de matière de
sulfate de cuivre hydraté (CuSO4, 5H2O) faut-il alors
dissoudre dans l’eau distillée ?
2) En déduire la masse de sulfate de cuivre à
peser.
3) Préparer cette solution appelée S0.
4) Chaque groupe préparera une deuxième
solution de sulfate de cuivre parmi les solutions suivantes :
|
Solution |
S1 |
S2 |
S3 |
S4 |
S5 |
S6 |
S7 |
|
cCuSO4 (mol.L-1) |
0,30 |
0,20 |
0,10 |
0,080 |
0,060 |
0,040 |
0,020 |
|
Vsol (mL) |
50 |
50 |
50 |
100 |
100 |
250 |
250 |
|
mCuSO4 (g) |
|
|
|
|
|
|
|
2)
Utilisation de l’échelle de teintes
Le
professeur a constitué une échelle de teintes (ensemble d’échantillons
d’une même solution de différentes concentrations molaires donc de coloration
différentes) à l’aide des solutions fabriquées.
Comparer
la couleur de l’échantillon de la solution S8 de concentration inconnue
aux échantillons de l’échelle de teintes et donner un encadrement de sa
concentration.
Données : M(H) = 1,0 g.mol-1 ; M(O) = 16,0 g.mol-1 ; M(S)
= 32,1 g.mol-1 ; M(Cu) = 63,5 g.mol-1