TP n°7 : Réaction Chimique.
Objectifs :
Introduction de la notion de transformation chimique (réactifs et produits)
1) Principe.
On fait réagir en différentes quantité des ions Cu2+ et HO-. On analyse le système après réaction chimique. Reste-t-il des ions Cu2+ et HO- ?
2) Matériel.
On dispose de flacons contenant le même volume de sulfate de cuivres (Cu2+ ; SO42-) à différentes concentrations:
- Solution 1 : C1 = 1,0 . 10-1 mol.L-1.
- Solution 2 : C2 = 2,0 . 10-1 mol.L-1.
- Solution 4 : C4 = 4,0 . 10-1 mol.L-1.
- Solution 6 : C6 = 6,0 . 10-1 mol.L-1.
- Solution 8 : C8 = 8,0 . 10-1 mol.L-1.
On dispose en outre d'une solution d'hydroxyde de sodium (Na+ ; HO-) de concentration C0 = 8,0 . 10-1 mol.L-1 .
à Quelle est l'espèce chimique responsable de la coloration bleue des solutions.
à Pourquoi la coloration bleue varie du clair vers le foncé ?
3) Expériences.
à Prélever 7 mL d'une des solutions de sulfate de cuivre dans un tube à essai. Dans un second tube à essai verser 7 mL de solution d'hydroxyde de sodium.
à Verser le contenu du tube à essai 2 dans le tube à essai 1 . Filtrer le mélange obtenu. Ne pas jeter le filtrat.
Observations :
- Précipité bleu (Cu(OH)2).
- Précipité plus abondant pour la solution 2 que la solution 1 (max. pour les solutions 4, 6 et 8).
- Filtrat incolore (solutions 1, 2 et 4) ou bleu (solutions 6 et 8).
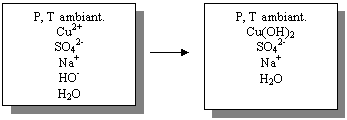 Interprétations
:
Interprétations
:
v Schéma de la transformation chimique :
v Equation chimique :
Cu2+(aq)
+ 2 HO-(aq) ® Cu(OH)2(s)
Réactifs Produits
v La quantité de filtrat augmente car n(Cu2+) augmente. On peut la calculer.
v Tests de présence des ions Cu2+ et HO- dans les filtrats. Chaque groupe divise en deux le filtrat et fait les deux tests. Conclusion dans un tableau.
|
Solutions |
1 |
2 |
4 |
6 |
8 |
|
Observations |
Filtrat incolore Précipité bleu |
Filtrat incolore Précipité bleu (+) |
Filtrat incolore Précipité bleu (++) |
Filtrat bleu Précipité bleu (++) |
Filtrat bleu Précipité bleu (++) |
|
n(Cu2+)initial [mol] |
7,0 .10-4 |
1,4 .10-3 |
2,8 .10-3 |
4,2 .10-3 |
5,6 .10-3 |
|
Réactif limitant |
Cu2+ |
Cu2+ |
Proportions stchiométriques |
HO- |
HO- |
|
Réactif en excés |
HO- |
HO- |
Cu2+ |
Cu2+ |
4) Conclusion.
v Réactif limitant : consommé entièrement lors de la transformation chimique.
v Réactif en excès : consommé partiellement au cours de la transformation chimique.
v Proportions stchiométriques : les proportions des réactifs pour qu'ils soient consommés en totalité au cours de la transformation chimique.