Arôme de banane
Q1
a) Un
composé artificiel peut être synthétisé en laboratoire. Le coût de production
est souvent inférieur à celui du composé naturel.
b)
L'acétate de butyle est un ester.
-COO-R
c) Réponse
partielle, pour voir la correction vidéo clique
ici.
A
: acide éthanoïque
B
: butan-1-ol
Q2
a) Il est
nécessaire de placer le bêcher dans un bain d'eau glacée de manière à stopper
la réaction d'estérification. Cette opération est appelée la trempe.
Plus la
température est élevée, plus la vitesse de réaction augmente, et inversement.
b) L'acide
sulfurique est le catalyseur de la réaction. Il l'accélère sans intervenir dans
son équation bilan.
c) Pour
voir la vidéo, clique
ici.
d) Le
mélange est stœchiométrique. Si la
réaction est totale, d'après l'équation bilan, il ne reste plus d'acide ni
d'alcool donc :
0,1 - xmax
= 0
xmax = 0,1
mol
L'avancement
maximal est de 0,1 mol.
Q3
a) L'indicateur coloré permet de repérer l'équivalence. En effet (s'il
est bien choisi! ) le pH à l'équivalence est compris dans sa zone de virage. Au
moment de l'équivalence la solution change de couleur.
b) Pour voir la réponse vidéo clique
ici.
c) A l'équivalence les réactifs ont
été introduits dans les conditions stœchiométriques de l'équation de
dosage (RCO2 H(aq) + HO-(aq) = RCO2-(aq) +
H2O(l) )
n(RCO2H)présent dans le tube = n(HO-) introduit
à l'équivalence
d) Réponse partielle, pour voir la réponse vidéo clique
ici.
![]()
Q4
Pour voir la correction vidéo clique
ici.
Q5
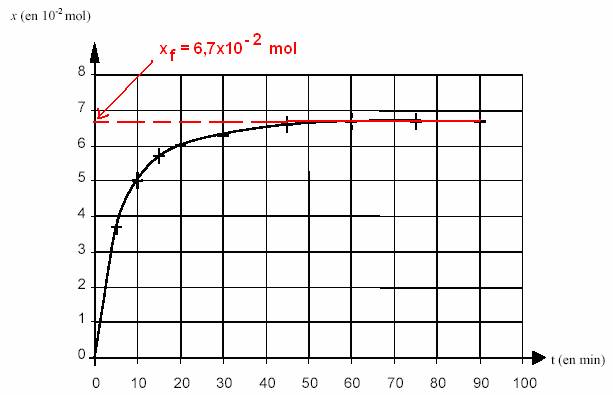
a)
L'avancement final correspond à la valeur prise par l'avancement à partir de t
= 60 min. La réaction est alors terminée (la vitesse de réaction est nulle).
xf = 6, 7 X 10-2 mol.L-1
Le
taux d'avancement final est égal au rapport entre l'avancement final et maximal
:
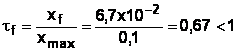
b) On
voit sur la courbe ci dessus que l'avancement final est obtenu au bout de 60
minutes ( ce qui laisse au chimiste le
temps d'aller acheter l'équipe). Par conséquent la réaction est lente.
Le
taux d'avancement final est inférieur à 1, par conséquent la réaction n'est pas
totale ( xf < xmax).
c)
Réponse partielle, pour voir la correction vidéo clique
ici.
d) ® Pour accélérer la synthèse de l'acide butanoïque,
il suffit de d'augmenter la température .
L'augmentation
de température augmente la vitesse de la réaction d'estérification, mais ne
modifie
pas son rendement( car la réaction est athermique). L'augmentation de
température permet d'atteindre plus rapidement l'état d'équilibre.
® En
augmentant l'excès d'un des réactifs (acide ou alcool) de la réaction
d'estérification, on augmente son rendement, et son taux d'avancement
final.
Par
exemple au lieu de prendre un mélange équimolaire d'acide et d'alcool, on va
prendre 5 fois plus d'acide que d'alcool.
e)
Réponse partielle, pour voir la correction vidéo clique
ici.
Il
faut utiliser l'anhydride éthanoïque.
On
rappelle que se sont les Slaves qui ont inventé le savon (astuce).