Conservateur et parfum (Bac 2006
Amérique du nord 6 points) énoncé
Partie
1 : propriétés de l’acide benzoïque
1)
Vidéo
Calcul de la masse à peser
Vo =
0,1 L ; M((C6H5COOH) =
![]()
La concentration massique ‘t’ en acide benzoïque
est :
![]()
La concentration massique ‘t’ est inférieure à la
solubilité s, la solution n’est pas saturée.
2) Réaction de l’acide benzoïque avec l’eau :
C6H5COOH(aq)
+ H2O(l) = C6H5COO- (aq) + H3O+(aq)
Il s’agit d’une réaction acide base, n’oubliez pas
d’indiquer dans quel
état se trouvent les espèces chimiques (aqueux )
3) Diagramme de prédominance des espèces chimiques :

Le pH-mètre indique dans la solution pH = 3.1 l’espèce
prédominante est l’espèce acide (acide benzo¨que)
Pour voir une vidéo sur le diagramme de prédominance clique
ici
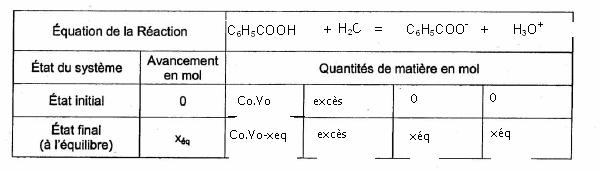
4) Tableau d’avancement de la réaction acido-basique
5) Vidéo
Avancement maximal
CoVo – xmax =
0
xmax = Co.Vo = 10-2x
0,1 = 10-3 mol
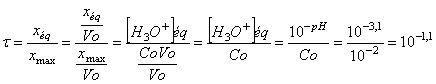
Le taux
d’avancement final est égal au rapport de l’avancement
à l’équilibre sur l’avancement maximal:
Le taux d’avancement final est très inférieur à
1. La réaction acide base est très limitée. Peu de
molécule d’acide réagissent, l’acide est donc bien
prédominant par rapport à sa base conjuguée. Le
résultat est bien conforme à la question 3.
6) Quotient de réaction à l’équilibre :
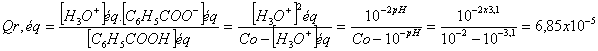
7) Le quotient de réaction à l’équilibre est
égal à la constante d’équilibre de l’acide
avec l’eau . Cette constante d’équilibre particulière
est appelée constante d’acidité notée KA :
Qr,éq = KA = 6,85x10-5
Or on donne le pkA1 =
10-KA1 = 4,2
KA1 = 10-pKA1
= 10-4,2 = 6,31 x 10-5 :
les 2 valeurs sont similaires.
B :
Réaction de l’acide benzoïque avec la soude
1) Le
pH = 6,2 : C6H5COO- prédomine

2)
Vidéo
C6H5COOH
(aq) + HO- (aq) = H2O(l)
+ C6H5COO- (aq)
La constante d’équilibre de la
réaction de titrage est :
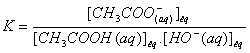
on multiplie l'expression de KA
par
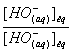
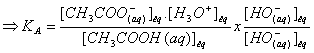
KA = K. Ke
![]() et KA= 10-pKa =10-4,8
et KA= 10-pKa =10-4,8
![]()
Partie II -
la synthèse du benzoate de méthyle
A - A propos
du mode opératoire
1) Quantité de
matière d’acide benzoïque :
![]()
Quantité de matière de méthanol :
![]()
2) Facteur cinétique :
température élevée
catalyseur :acide sulfurique
3) Chauffage :élévation de température ,
augmentation de la vitesse de réaction
à reflux : les réactifs ou produits qui se vaporisent se
condensent au contact du condenseur (ça ne s’invente pas !) et
reflux (hé oui) dans le ballon.
B :
étude de la réaction de synthèse du benzoate de
méthyle
1) Réaction d’estérification :
C6H5COOH(aq) + CH3OH (aq) = H2O(l)
+ C6H5COOCH3 (aq)
Pour voir un exemple filmé de réaction
d’estérification clique
ici.
2) Réactif limitant :
D’après l’équation bilan
précédente :
n1 – xmax = 0 ; xmax = n1
= 0,1 mol
ou
n2 – xmax = 0 ; xmax = n2
= 0,75 mol
xmax = 0,1 mol
Le réactif limitant est l’acide benzoïque
3) Rendement de la
réaction :
C’est le rapport entre la quantité de matière
d’ester obtenue sur la quantité de matière d’ester
obtenue si la réaction est totale :
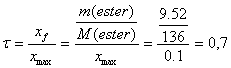
Le
rendement est de 70%