Étude d'une estérification (Inde 2003 ; 6 points)
1)a) Réaction d’estérification
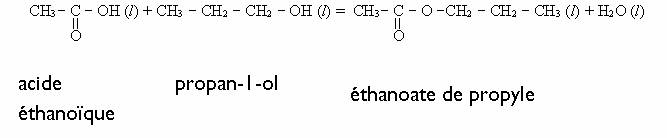
Pour voir
un exemple de réaction d’estérification clique
ici
1)b) n = 0,500 mol
![]() et m = r.V donc
et m = r.V donc
![]() =
= ![]()
1)c) Vidéo
nE(t) : quantité d'ester formé à une date t
na
restant (t) la quantité de matière d'acide restant,
D’après
l’équation bilan de la réaction d’estérification précédente :
na restant(t) = 0,500 - nE(t)
nE(t) = 0,500 - na restant(t).
2) a)
Réaction de titrage
CH3COOH
(aq) + HO-(aq) = CH3COO-
(aq) + H2O (l)
2) b) Pour voir un exercice similaire clique ici
La
constante d'acidité est égale à la constante d’équilibre de la réaction entre
l'acide éthanoïque et l'eau.
CH3COOH (aq) + H2O (l) = CH3COO- (aq) + H3O+ 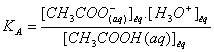
La
constante d’équilibre de la réaction de titrage est :
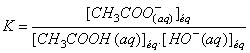
on
multiplie l'expression de KA par
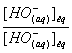
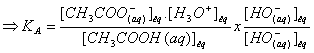
KA = K. Ke
![]() et KA=
10-pKa =10-4,8
et KA=
10-pKa =10-4,8
![]()
La
constante de réaction a une valeur très grande (>>103) :la
réaction de titrage est totale.
.
2) c) Vidéo
A
l'équivalence, les réactifs ont été introduits dans les proportions
stœchiométriques : le nombre de mole d’acide éthanoïque restant dans les 5
mL ( nA) est
égal au nombre de mole de soude versée à l’équivalence nb,E
nA = nb,E
nA = cb.Véq
nA = 1,0´14,2.10-3 = 14,2.10-3 mol
Dans la
fiole jaugée de 100mL il restait donc après une heure :
na
restant (1h) = 20 ´ 14,2.10-3 = 0,284 mol d'acide éthanoïque.
Le nombre
de mole d’ester formé est donc au bout d’une heure :
nE(t) = 0,500 - na restant (t) =0,5 – 0.284 = 0,216 mol
nE(1h) = 0,216 mol d'ester formé.
3) a)
D’après le graphe x = f(t) , xeq = 0.335
mol
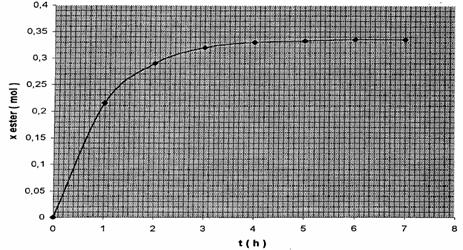
Le tableau
d'évolution du système en découle ……..Les quantités de matière sont exprimées
en mole
|
équation chimique |
acide
éthanoïque + propan-1-ol = ester + eau |
||||
|
Etat du système |
Avancement (mol) |
Quantités de matière (mol) |
|||
|
Etat
initial |
x = 0 |
0,500 |
0,500 |
0 |
0 |
|
En cours
de transformation |
X |
0,500 - x |
0,500 - x |
x |
x |
|
Etat final (équilibre) |
xéq = 0,335 |
0,500 - xéq
= 0,165 |
0,500 - xéq
= 0,165 |
xéq = 0,335 |
xéq = 0,335 |
|
Etat
final (si
transfo. totale) |
xmax= 0,500 |
0,500 - xmax
= 0 |
0,500 - xmax
= 0 |
x max = 0,500 |
x max = 0,500 |
xmax = 0,500 mol
xéq < xmax , donc la transformation est
limitée.
Le rendement
‘r’ est égal au rapport de la quantité de matière d’ester obtenu (x eq ) sur la quantité de matière d’ester obtenu
si la réaction est totale (xmax) :
![]()
Le
rendement de la réaction d’estérification est r= 67%
3)b) La vitesse volumique de réaction
v(t) à l’instant ‘t’ est égale à la dérivée de l’avancement par rapport au
temps à l’instant ‘t’, multipliée par l’inverse du volume de solution :
![]()
(dx/dt)t est égal à la
valeur du coefficient directeur de la tangente à la courbe représentant
x(t) à l’instant considéré. La vitesse
de réaction est proportionnelle au coefficient directeur de la tangente à la
courbe représentant x(t). Ce coefficient directeur diminue au cours du temps
(la pente de la courbe diminue) . La vitesse de réaction diminue au cours du
temps, elle est maximale à t =0 (pente maximale) et nulle quand la réaction est terminée (x = xeq)
3c) Constante d’équilibre K’ de la
réaction d’estérification
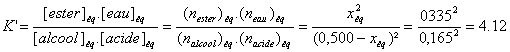
3d) Vidéo
Rappel :
|
Etat final (équilibre) |
xéq = 0,335 |
Acide 0,500 - xéq
= 0,165 |
Alcool 0,500 - xéq
= 0,165 |
Ester xéq = 0,335 |
Eau xéq = 0,335 |
On ajoute
1mol d'acide éthanoïque, on obtient
1,165 mol d'acide.
Le quotient
de réaction devient :
![]()
Qr < K
= 4,52
La
transformation évolue dans le sens direct, il se forme à nouveau de l'ester et
de l'eau. Pour déterminer le nouveau rendement il faut calculer la nouvelle
valeur de xeq. Pour cela on reprend la
valeur de la constante d’équilibre qui ne dépend pas des conditions
initiales :
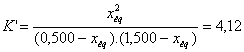
On résoud l’équation du second degré en ‘xéq’
on obtient 2 solutions :
xeq = 2,19 mol impossible car xéq
< xmax
et xéq 2 = 0,45
mol
Le nouveau rendement ‘r’ est :
![]()
Le rendement
est toujours amélioré en augmentant l’excès d’un des 2 réactifs (le moins cher
de préférence !!!)