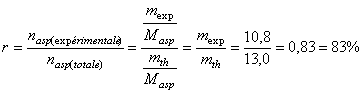HÉMISYNTHÈSE
DE L'ASPIRINE AU LABORATOIRE (Amérique du Sud 2003 ; 6,5 points)
Les
deux groupes fonctionnels (ou caractéristiques).
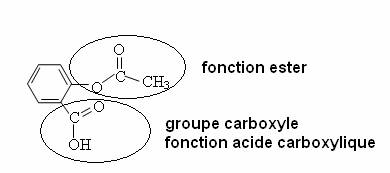
2.1. Cette réaction
est appelée une réaction
d’estérification.
2.2. Vidéo
Equation de la réaction :
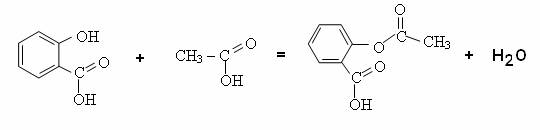
2.3. Quelles sont ses
principales caractéristiques ?
Une réaction d’estérification est lente et limitée.
3.1.
Tableau descriptif de l'évolution du système chimique
Equation
|
ROH + RCO2H = ester + H2O |
|||
|
Quantité de matière dans l'état initial (en mol) |
0,10 |
0,10 |
0 |
0 |
|
Quantité de matière en cours de transformation (en mol) |
0,10 – x |
0,10 – x |
x |
x |
|
Quantité de matière théorique dans l'état final (en mol) |
0,10 – xmax
= 0 |
0,10 – xmax
= 0 |
xmax |
xmax |
|
Quantité de matière dans l'état
final (en mol) |
0,10 – xf |
0,10 – xf |
xf |
xf |
3.2.1. Vidéo
Quotient
de réaction Qr en fonction de l'avancement
x de la réaction :
.
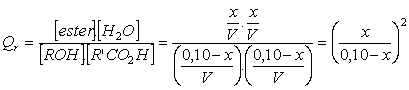
3.2.2. Vidéo
Valeur
de Qr,i : à t =0, x = 0 donc :
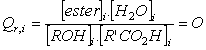
3.2.3. La
constante d'équilibre K = 7,0 ´ 10 –3 est supérieur à Qr,i = 0 : le sens d'évolution de la réaction se fait
dans le sens direct (lecture de gauche à droite suivant l’écriture de
l’équation bilan )
3.3.1.
Lorsque Qr
= K alors Qr
= Qr,éq et x = xf
.
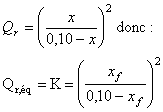
3.3.2.
En déduire la valeur numérique de xf.
Pour Déterminer la valeur de xf,
il faut résoudre l’équation
du second degré :
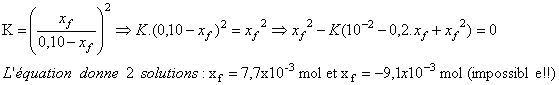
3.3.3. Le taux d'avancement final de la
transformation est égal au rapport de l’avancement final sur l’avancement
maximal :
![]()
3.3.4.
Le tableau
d’avancement donne : 0,10
– xmax = 0 donc xmax
= 0,10 mol ; xf = 7,7x10-3 mol.
![]()
4.1.1. Ce type de montage est appelé un montage à reflux.
4.1.2. Le rôle du réfrigérant à boules est de condenser les vapeurs de réactifs et de
produits qui refluent dans le ballon. On chauffe le milieu réactionnel sans
perte d’espèces chimiques.
4.1.3. On chauffe le mélange réactionnel afin d’accélérer la réaction.
4.1.4. L'acide sulfurique est le catalyseur de la réaction.Il augmente la
vitesse de réaction sans intervenir dans son équation bilan.
4.1.5. Il utiliser un ballon bien sec pour éviter que l’eau ne
réagisse sur l’anhydride d’acide pour donner de l’acide éthanoïque?
4.1.6. Pour
introduire l'anhydride éthanoïque et l'acide sulfurique concentré dans le ballon, il faut manipuler
sous la hotte avec des gants et des lunettes et porter une blouse.
4.2.1.
Calcul des quantités de matières initiales :
Anhydride
éthanoïque :
![]()
Acide
salicylique :
![]()
D’après
l’équation bilan :
na
–xmax = 0 donc xmax
= 0,13 mol
ou
nas –xmax
= 0 donc xmax = 7,25x10-2 mol
Conclusion :
l'anhydride éthanoïque est en excès.
4.2.2. Masse théorique mth d'aspirine que l'on peut
obtenir en considérant cette transformation comme
totale :
xmax = 7,25x10-2 mol
D’après l’équation bilan la quantité de
matière maximale d’aspirine pouvant être obtenue est : nasp(max)
= xmax
mth = xmax
.Masp = 7,25x10-2 x180 = mth
=
4.2.3. Le rendement est égal au rapport de la quantité de
matière théorique d’aspirine obtenue sur la quantité de matière d’aspirine
obtenue si la réaction est totale :