De la poudre
de tara au gallate de propyle (2005 Liban)
A –
"Extraction" de l'acide gallique
1.a)
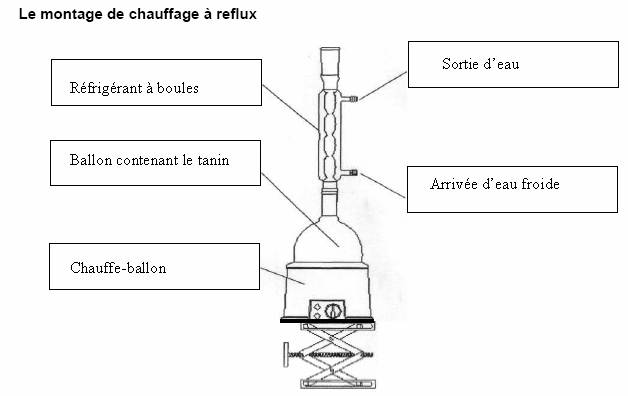
A.1.b) Le chauffage à reflux permet d’accélérer la
réaction, car en augmentant la température :
* on augmente la vitesse de réaction dans le sens direct (et
éventuellement inverse, si la réaction n’est pas totale)
* on arrive plus rapidement à l’état
d’équilibre
De plus le chauffage à reflux minimise la pertes de réactifs
ou de produits. En effet les vapeurs en s’élevant dans le ballon
se condensent dans le réfrigérant et retombent dans le
mélange réactionnel.
A.1.c) Pour déterminer grossièrement la valeur du pH on
utilise un papier indicateur de pH.
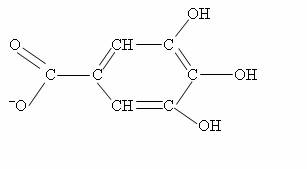
A.2. Formule développée de l’ion gallate :
A.3.a) Réaction de l’acide gallique avec l’eau :
AH(aq) + H2O(l) = A–(aq) + H3O+(aq)
A.3.b) l'expression de la constante d'acidité Ka du couple AH/A–
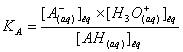
Attention, l’eau est le solvant on remplace sa concentration par
‘1’ dans l’expression de la constante d’acidité.
A.3.c. Vidéo.
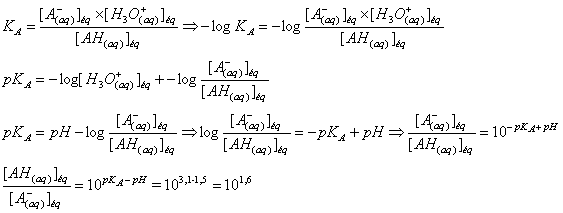
[AH(aq)]éq
> [A–(aq)]éq
L’espèce prédominante est l’acide gallique AH.
A.3. d) Vidéo
Les domaines de prédominance de AH et A– .
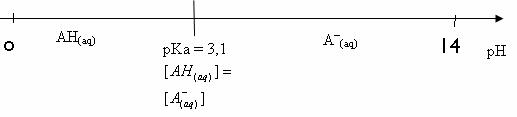
A.3.e) A pH = 1,5 l’acide gallique est prédominant ; celui ci
est très peu soluble dans l'eau froide, il précipite. En laissant
le mélange décanter, puis en le filtrant, on pourra
récupérer l’acide AH .
A.3.f) Un corps pur change d’état à température
constante. On pose un peu de produit obtenu sur un banc Köffler
et on détermine sa température de fusion. Si elle est
égale à celle de l’acide gallique, le produit obtenu est de
l’acide gallique pur. On peut également procéder à
une chromatographie.
B- De
l'acide gallique au gallate de propyle
B.1) Vidéo
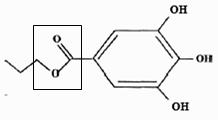
Le groupe caractéristique obtenu est le groupe ester ; il
est encadré dans la formule topologique du gallate de propyle
B.2) La synthèse du gallate de propyle est
effectuée à partir du propan-1-ol :
![]()
B.3.a) Vidéo.
Synthèse du gallate de propyle.
C6H2(OH)3–COOH
+ CH3–CH2–CH2–OH = H2O(l)
+ C6H2(OH)3–COO–CH2
–CH2–CH3
B.3.b) Il s’agit d’une réaction d’estérification.
Cette réaction est lente et limitée.
B.3.c) L’acide sulfurique est le catalyseur de la réaction. Il
augmente la vitesse de réaction, mais n’intervient pas dans son
équation bilan. Il ne modifie pas :
l'avancement final
le taux d’avancement final
B.3.d) La pierre ponce permet de réguler l'ébullition, et mettre les
réactifs en contact.
B.4. Vidéo.
Définition du rendement
h = ![]()
D’après l’équation bilan
d’estérification si la réaction
d’estérification est totale :
n(acide initial) = n(ester)th
= m(acide)/M(acide)
![]() mester =
mester = ![]()
La masse d’ester obtenue sera d’environ 15g
B.5. Plus l’un des réactifs est en excès plus le rendement
de la réaction est important. On obtiendra par conséquent une
quantité de matière de gallate de propyle
supérieure.