Fabrication
puis titrage de l’aspirine (Pondichéry bac 2004) énoncé
Q1
a) Pour voir un exercice similaire corrigé par vidéo clique ici.
R-COOH
+ R’-CH2-OH = R-COO-CH2-R’
b)
|
Equation |
R-COOH +
R'-CH2OH = R-COO-CH2-R' + H2O |
||||
|
Etat |
Avancement (mol) |
Quantités de matière (mol) |
|||
|
RCOOH |
R'-CH2OH |
ester |
H2O |
||
|
Etat initial |
x = 0 |
0,20 |
0,20 |
0 |
0 |
|
Etat intermédiaire |
x |
0,2 - x |
0,2 - x |
x |
x |
|
Etat d'équilibre |
x = xéq |
|
|
|
|
c) Si la réaction était totale le nombre de moles de réactifs en fin de réaction serait nul :
0,2 – xmax = 0
xmax = 0,2 mol
L’avancement maximal serait égal à 0,2 mol.
d)
|
Equation |
R-COOH +
R'-CH2OH = R-COO-CH2-R' + H2O |
||||
|
Etat |
Avancement (mol) |
Quantités de matière (mol) |
|||
|
RCOOH |
R'-CH2OH |
ester |
H2O |
||
|
Etat initial |
x = 0 |
0,20 |
0,20 |
0 |
0 |
|
Etat intermédiaire |
x |
0,2 - x |
0,2 - x |
x |
x |
|
Etat d'équilibre |
x = xéq |
0,2 – xeq |
0,2 – xeq |
xeq |
xeq |
Réponse partielle, pour voir la correction vidéo clique ici.
r = 0,65
Définition du rendement, clique ici.
Q2
a) Réponse partielle, pour voir la correction vidéo clique
ici.
Il s’agit de l’impayable anhydride éthanoïque.
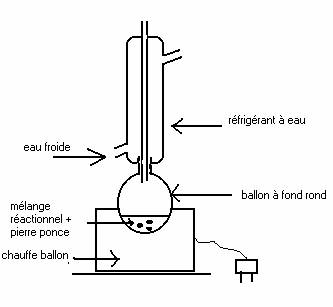
b) Montage à reflux :
c) Réponse partielle, pour
voir la correction vidéo clique
ici.
Réactif limitant : l’acide salicylique.
d) Réponse partielle, pour voir la correction vidéo clique
ici.
Masse d’aspirine obtenue si le rendement est de 100%
m = 6,51 g
Rendement
effectif : 0,65
Q3
a) Quantité de matière no d’ions HO-
ajoutés à l’aspirine pour fabriquer S1 :
no
= Co.Vo = 20 x 10-3 x 1 = 20 x 10-3 mol.
b) On rappelle que la soude (hydroxyde de sodium) à pour
formule (Na+,HO-) ; l’acide chlorhydrique à pour
formule
(H3O+,Cl-).
La réaction de dosage de la soude en excès est :
H3O+aq + Cl-aq + Na+aq
+ HO-aq = 2 H2Ol + Cl-aq + Na+aq
A remarquer que les ions chlorure et sodium sont au
spectacle comme d’habitude ( sont spectateurs).
N’oubliez pas de noter que les ions sont sous forme aqueuse
(‘aq’ en indice). Des correcteurs très méchants peuvent vous enlever des points
(j’en fais partie).
c) La phrase qu’on attend fébrilement en réponse à ce type
de question :
A l’équivalence le nombre de moles d’acide versé (C1V1)
est égale au nombre de moles de soude n1 présent dans le
bêcher :
n1 = C1.V1 = 5 x 10-2
x 7,4 x 10-3 = 3,7 x 10-4 mol
Quantité de matière d’ions HO- en excès dans la
solution, réponse partielle, pour voir la correction vidéo clique
ici.
Rappel : Quantité de
matière no d’ions HO- ajoutés à l’aspirine pour fabriquer
S1 : no = Co.Vo = 20 x 10-3 x
1 = 20 x 10-3 mol.
Le nombre de moles d’ions hydroxyde restant dans la solution
S1 est : n2 =
nsoude excès = no – 2.xmax= no –
2.nasp
On ne dose que 10 mL de la solution S2 de volume
total égal à 250 mL . Ces 10 mL contiennent un nombre de moles de soude égale à
n1.
Le nombre de moles de soude en excès dans la solution S1
est :
n2 =
(250/10) x n1 = no –2.nasp = 25 x 3,7 x 10-4
= 9,25 x 10-3 mol
d) Nombre de moles et masse d’aspirine.
n2 =
no –2.nasp
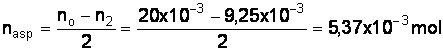
masp =
nasp x Masp = 5,37 x 10-3 x 180 = 0,967 g
e) Pour comparer la valeur trouvée expérimentalement à celle
pesée (mpesée = 1 g), il convient de faire un calcul d’erreur
relative :
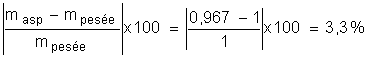
On obtient moins d’un gramme d’aspirine . Cela signifie que le cachet
d’aspirine contient des impuretés.
Le conseil du jour : ne manger que 96,7% du cachet et recracher les 3,3% d’impuretés.