Préparation d'un ester (énoncé)
Q1
Voir
la vidéo pour les différents esters possibles.
Q2
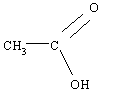
a) L'acide est l'acide éthanoïque, l'alcool est le 3-méthylbutan-1-ol. Il s'agit d'un alcool primaire car le carbone
fonctionnel (qui porte le groupement hydroxyle -OH) n'est lié qu'avec un seul
autre atome de carbone.
Acide éthanoïque
3-méthylbutan-1-ol
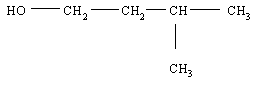
b) Pour l'écriture de la réaction voir la
vidéo. Caractéristiques de cette réaction : lente limitée et athermique.
c) Réponse partielle, pour voir la vidéo clique
ici.
V2 = 23,1 x 10-3 L
Q3
a) Schéma de principe du montage à reflux.
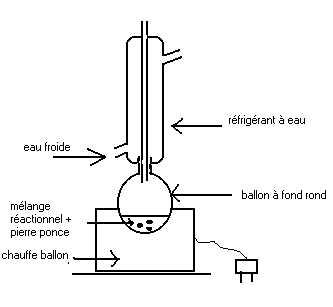
b) Le rôle de la pierre ponce est de réguler l'ébullition.
c) Comme la réaction est athermique, en chauffant le mélange, on augmente la vitesse de formation de
l'ester.
Remarque : La réaction hydrolyse de l'ester est également augmentée. En
élevant la température du mélange réactionnel on atteint plus rapidement l'équilibre
chimique (Qr = K) .
d) Le réfrigérant à eau sert à condenser et récupérer dans le ballon les espèces chimiques qui se sont vaporisées. De cette
manière on ne perd ni produits ni réactifs.
Q4
a) données :
|
|
Solubilité dans l'eau |
Masse volumique |
|
Acide
A Alcool B ester |
Bonne très faible
très faible |
1,05.103 g.L-1 8,10.102 g.L-1 8,70.102 g.L-1 |
Ampoule à décanter

L'ester et l'alcool sont dans la phase supérieure car leur masse volumique (et donc leur densité) sont
inférieures à celles de l'eau et de l'acide. De plus l'ester possède une très
faible solubilité dans l'eau, par conséquent il se retrouve presque entièrement
dans la phase organique.
b) Nom des appareils :
A : thermomètre ; B : condenseur ; C : erlenmeyer ; D : colonne de
distillation; E : milieu réactionnel (alcool + acide + acide sulfurique ) ; F :
chauffe ballon ; G : arrivée d'eau froide ; H : ballon à fond rond ;
c) Données :
|
|
Température d'ébullition |
|
Acide
A Alcool B ester |
118°C 128°C
143°C |
Il faut surveiller la température car, tant que le thermomètre n'indique
pas 143°C, l'ester ne se volatilise pas, et n'est pas recueilli dans
l'erlenmeyer.
Q5
a) Réponse partielle pour voir la vidéo clique
ici.
r = 50%
b) Le rendement n'atteint pas encore 67% par conséquent la réaction n'est
pas terminée, la vitesse de réaction n'est pas nulle :
![]()
Le quotient de réaction tend vers la constante K, mais lui est encore
inférieur:
Qr < K
c) Réponse partielle, pour voir la vidéo clique
ici.
Equation bilan est : C2H4O2(aq) + C5H12O(aq)
= H2O(aq) + C7H14O2
La constante d'équilibre est :
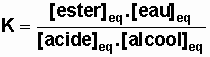
Application numérique :
K = 4,12
Q6
a) Pour voir la vidéo clique
ici.
b) D'après les nombres stœchiométriques, il faut utiliser un nombre
identique de moles d'anhydride d'acide et d'alcool :
n (anhydride d'acide) = n (alcool) = 0,405 mol.
c) La réaction entre un anhydride d'acide et un alcool est totale et assez rapide.
Lorsque la réaction est terminée le nombre de mole d'ester obtenu est
égal au nombre initial de mole d'alcool :
n(ester)obtenu = 0,405 mol
(x = xmax = n(alcool) i )
|
tableau d'avancement
(facultatif)
|
C4H6O3 |
C5H12O |
C2H4O2 |
C7H14O2 |
|
Etat initial |
0,405 mol |
0,405 mol |
0 |
0 |
|
Etat final |
0,405 - xmax =
0 xmax= 0,405 mol |
0,405 - xmax =
0 |
xmax= 0,405
mol |
xmax= 0,405
mol |