Un procédé
discontinu de fabrication du savon (Ministère)
Q1
a) Réponse
partielle pour voir la vidéo clique
ici :
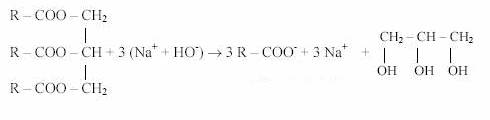
b) Réponse partielle, pour voir la
vidéo clique ici.
R est la partie hydrophobe, et COO- est la partie hydrophile.
Q2
a) Au cours de la phase de démarrage, la courbe n'est pas
très inclinée donc la vitesse de la réaction n'est pas très grande.
Lors de la phase de saponification
rapide, la courbe croît de façon beaucoup plus importante au cours du temps, on
en déduit donc que la vitesse est plus grande.
Enfin au cours de la phase de fin de
saponification, la courbe tend vers une asymptote horizontale ce qui signifie
que la vitesse tend vers 0.
b) Il est rappelé au début du sujet
que les graisses et les huiles sont insolubles dans l'eau. Or la réaction de
saponification met en jeu des triglycérides et de la soude, deux substances
insolubles. Pour maintenir l'émulsion
de deux substances
non miscibles, il est nécessaire d'agiter.
c) Réponse partielle,
pour voir la correction vidéo clique
ici.
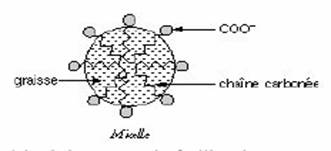
Les ions carboxylate vont se lier :
- par leur
partie hydrophile à
l'eau contenue dans
la solution de soude ;
- par leur partie
hydrophobe aux molécules de triglycéride.
Il y aura ainsi formation de micelles.
d) L'intérêt de disperser la graisse dans l'eau, est
de faciliter la rencontre entre les molécules
de triglycérides et les ions hydroxyde.
Au fur et à mesure que la réaction de saponification a lieu, les concentrations des
réactifs diminuent ; ceci
entraîne la diminution de la
vitesse de la réaction lors de la troisième phase.
Q3
a)
Termes correspondant à la légende du schéma :
1) La graisse et la soude
2) La vapeur d'eau
3) La cuve
4) Le fond de savon
5) Le serpentin
b) Le savon, en rendant miscibles les
deux réactifs, augmente la
vitesse de la réaction.
c) La
vapeur d'eau qui
circule au fond
de la cuve
dans un serpentin, permet de
porter le mélange à ébullition.
Une température élevée augmente la vitesse de la réaction.