Chapitre 2 : suivi temporel
d’une réaction chimique
Étude cinétique par
conductimétrie
Q1
a) Demi-équations électroniques pour chacun des deux
couples qui interviennent dans cette réaction.
S2O82- + 2 e- = 2 SO42-
½ réaction de réduction car
gain d’électrons
2I- = I2 + 2 e-
½ réaction d’oxydation car
perte d’électrons
b) Réaction entre les ions peroxodisulfate
et les ions iodure.
S2O82- + 2I- = 2 SO42- +
I2
c) Les quantités de matière sont exprimées en mole
|
Relation stœchiométrique |
2I–
(aq)
+
S2O82–(aq)
=
I2 (aq)
+ 2 SO42– (aq) |
||||
|
Avancement |
Quantité de
matière en mol |
||||
|
État
initial |
C2V2
= 1,5x10-1x60x10-3 = 90x10-4 |
0 |
0 |
||
|
Au
cours de la transformation |
x |
90x10-4
– 2x |
40x10-4
– x |
x |
2x |
|
État
final attendu |
xmax |
90x10-4
– 2xmax = 10x10-4 |
40x10-4
– xmax = 0 |
xmax = 40x10-4 |
2xmax
= 80x10-4 mol |
Calcul de xmax
90x10-4
– 2xmax = 0 ; xmax =
45x10-4 mol
40x10-4
– xmax = 0 ; xmax = 40x10-4 mol
Conclusion :
xmax = 40x10-4 mol ; le
réactif en défaut est le peroxodisulfate.
d) Vidéo
V =V1 + V2
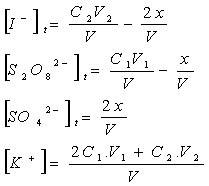
Q2
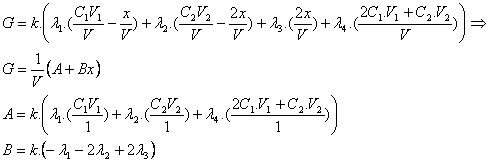
Q3
a) Vidéo
La vitesse volumique 'v(t)'
d'une réaction calculée à l'instant 't' est égale
à la dérivée de l'avancement 'x' par rapport au temps,
divisée par le volume V de solution :
![]()
Unité légale : mol.s-1m-3.
b) Vidéo
G= (1/V).(A + Bx)
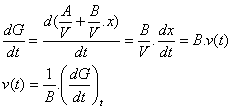
c) Vidéo
Valeur vo de la
vitesse volumique à la date t = 0 s (instant du début de
réaction).
![]()
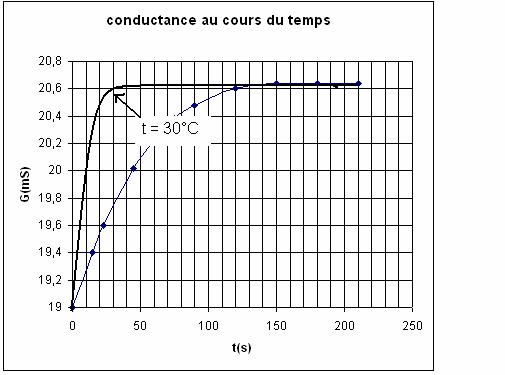
Calcul de (dG/dt)t
= 0
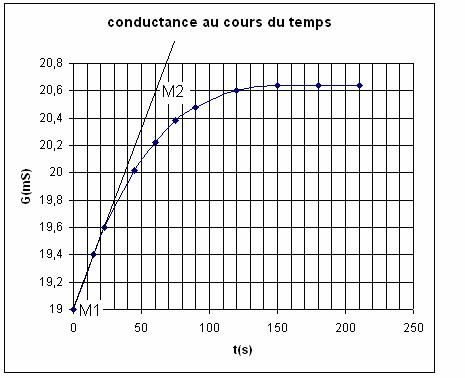
1) on trace la tangente à la courbe à l’instant t =
0 ;
2) on prend 2 points de cette tangente
M1 ( t1 = 0 s ; G1 =
19 mS) ; M2 (t2 = 50 s , G2 = 20,6 mS)
3) on calcule la pente qui est égale à (dG/dt)t = 0
![]()
4) On calcule v(o)
![]()
Q4
a) Le
temps de demi-réaction est la durée au bout de laquelle
l'avancement est égal à l'avancement final divisée par 2 :
![]()
Dans le cas où la réaction est
totale, xf = xmax par conséquent le temps
de demi-réaction est la durée au bout de laquelle l'avancement
est égal à la moitié de l'avancement maximal :
![]()
b)
G= (1/V).(A + Bx)
*A t = 0 x
=0 donc Go = A/V or A = 1,9 mS.L et V =100 mL =
0,1L
Go = A/V = 1,9/0,1 = 19 mS .
Sur le graphique on lit
qu’à t = 0, Go = 19 mS, les 2 valeurs sont identiques ouf !
* A la
fin de la réaction, Gmax=
(1/V).(A + Bxmax) = (1/0,1)x(1.9+42x40x10-4)
= 20,7 mS
Sur le
graphique on lit sensiblement la même valeur.
c) Vidéo
G1/2 = (1/V).(A + Bxmax/2) = Go + (B/V).(xmax/2)
Gmax = Go +
(B/V). max
xmax = (Gmax – Go).(V/B)
G1/2
= Go +1/2.(Gmax – Go)
d) G1/2 = Go +1/2.(Gmax
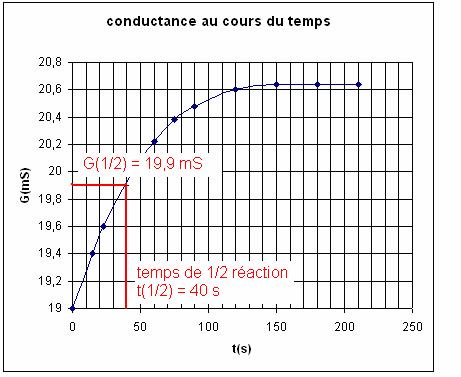
– Go) = 19 + ½ (20,7 – 19) = 19,9 mS
D’après
le graphique t(1/2) = 40 s
e) Vidéo
La valeur de xmax ne
change pas, donc celle de Gmax non plus. Seule la
vitesse augmente. Or la vitesse est proportionnelle à la pente de la
tangente à la courbe G = f(t) car :
![]()
Donc la pente de la tangente
à la courbe est plus importante en chaque instant. Allure de la
courbe :