Une
réaction dans un
verre d’eau
Q1
a) Vidéo
Nombre de moles d’aspirine n(asp): M = 180 g.mol-1; masse théorique d’aspirine m = 0,5
g :
![]()
Nombre de moles d’ion hydrogénocarbonate n(HCO3-) : V1 = 10 mL = 10-2
L; C1 = 0,5 mol.L-1 ( à remarquer
que la concentration en ion hydrogénocarbonate et en ion sodium est égale
à C1)
n(HCO3-) = C1 . V1 = 0,5 x 10-2
mol = 5 x 10-3 mol.
D’après la réaction :
C9H8O4 + HCO3-
= C9H7O4- + CO2 + H2O
Les conditions stœchiométriques sont obtenues pour
: ![]()
Or d’après les calculs précédent, n(HCO3-) =
0,5 x 10-2 mol > n(asp) = 2,78 x 10-2
mol
Les ions hydrogénocarbonate sont en excès,
l’aspirine peut être entièrement consommée.
b) Le nouveau volume de la solution est : V =
V1 + V2 = 150 +10 = 160 mL = 160 x 10-3
L
La nouvelle concentration en ion
hydrogénocarbonate (on a effectué une dilution de la concentration
apportée) est:
![]()
Q2
a) Vidéo
Nombre de mole de dioxyde de carbone en fonction
de sa pression. Attention aux unités légales : V = 300 mL
= 300 cm3 = 300x(10-2m)3 = 300 x 10-6
m3 ;
T = q
+ 273 = 273 + 26 = 299 K
R = 8,31 USI
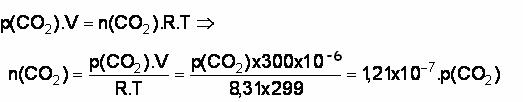
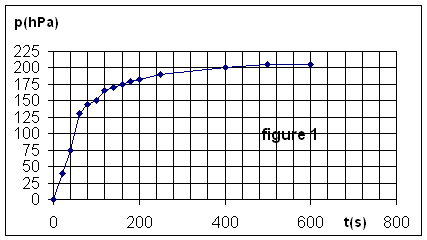
b) D’après la courbe, en fin de réaction (au bout de
600 s) p(CO2) = 210 hPa
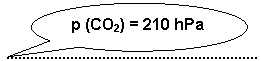
La relation entre le nombre de moles de dioxyde de
carbone, et la pression en hectopascal est :
n(CO2 )
= 1,21 x 10-5 . p(CO2) . Par conséquent
: n(CO2 ) = 1,21 x 10-5 x 210 = 2,6 x 10-3
mol.
Q3
a) Tableau d’avancement de la réaction. Les
valeurs numériques sont données en mole.
|
Etat
du système |
Avancement |
C9H8O4 |
HCO3- |
C9H7O4- |
CO2 |
H2O |
|
État
initial |
x =
0 |
n(asp) |
C1.V1 = 5x10-3 |
0 |
0 |
0 |
|
En
cours |
x(t) |
n(asp) – x (t) |
|
x(t) |
x(t) |
x(t) |
|
|
x(max) |
n(asp)-x(max) = 0 |
5x10-3-x(max) |
x(max) |
x(max) |
x(max) |
b) Vidéo
D’après le tableau
d’avancement, la quantité d’aspirine consommée et le nombre de moles de dioxyde
de carbone produit sont égaux à
x(t) :
n(asp)consommé = n(CO2)formé =
x(t)
c) Masse d’aspirine
contenue dans le cachet : la masse d’aspirine entièrement consommée, n(asp), est égale au nombre maximal de moles de dioxyde de
carbone formé (2,6 x 10-3 mol) :
m(asp) = n(asp) . M = n(CO2)formé
en fin de réaction = 2,6 x 10-3 x 180 = 0,47 g
d)
Calcul de l’erreur relative entre la masse théorique et expérimentale :
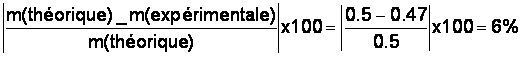
Conclusion : il
existe un léger écart entre la valeur théorique et expérimentale. Erreur expérimentale?
Négligence du fabriquant ? Le mystère reste entier.
Q4
a)
Vidéo
A
t = 40 s, d’après la courbe p(CO2) = 75 x 102 Pa
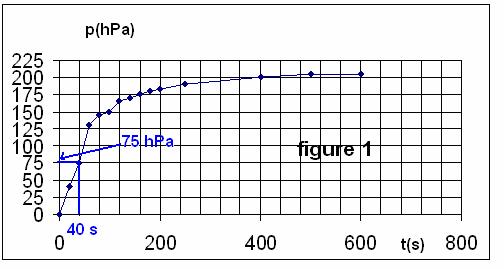
Le nombre de moles de
dioxyde de carbone formé à cet instant est : n(CO2)
= x(t) = 1,21 x 10-5 x p (CO2)
= 1,21 x 10-5 x 75 = 9,1 x 10-4 mol
La concentration en ion
hydrogénocarbonate est d’après le tableau d’avancement (en mol.L-1):
|
Etat
du système |
Avancement |
C9H8O4 |
HCO3- |
C9H7O4- |
CO2 |
H2O |
|
État
initial |
x =
0 |
n(asp)/V1 |
C1 =
5x10-3 |
0 |
0 |
0 |
|
En
cours |
x(t) |
n(asp)/V1 |
|
x(t)/V1 |
x(t)/V1 |
x(t)/V1 |
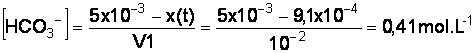
b) Volume de dioxyde de
carbone qui s'est dégagé. VM =
24L.mol-1
![]()
c) Concentration en ion
C9H7O4- dans la solution?
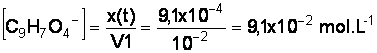
Q5
a) Vidéo
Démontrons que la densité d'un gaz A est donnée
par la formule :
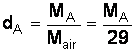

b) densité du dioxyde carbone. M ( C ) =12 g.mol-1 ; M( O ) = 16 g.mol-1
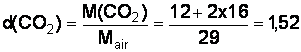
c) Le dioxyde de carbone est plus dense que l’air
( d(CO2) > 1 ). Le niveau du tunnel doit être plus élevé au centre
qu’aux extrémités de manière à laisser s’écouler ce gaz à l’extérieur. Dans le
cas contraire, le dioxyde de carbone s’accumulerait au centre du tunnel ce qui
serait dangereux pour les automobilistes.