DEUX
ANTISEPTIQUES (Nouvelle Calédonie 2005 )
1. Courbe d’étalonnage du spectrophotomètre
1.1. La
courbe représentative de A = f([I2]), figure 1, est une droite
qui passe par l’origine. L'absorbance est proportionnelle à la
concentration en diiode. La fonction f est une
fonction linéaire :
A = k[I2]
k
représente la pente de la droite ou le coefficient de proportionnalité.
1.2. Au point
d’ordonnée Amax = 2,00 correspond l’abscisse :
[I2]max
= 8x10-3 mol.L-1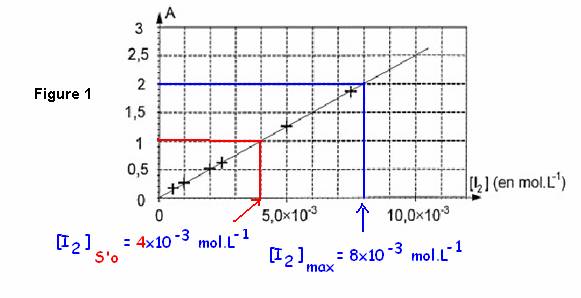
2. Titre du Lugol
2.1. La solution est diluée dix fois : on
utilise une pipette jaugée de 10 mL, surmontée d’un pipeteur, pour prélever la solution mère.
On la verse dans une
fiole jaugée de 100,0 mL. On
complète avec de l’eau distillée, on bouche.
2.2.1. l’abscisse du point d’ordonnée A S’o =
1,00, est :
[I2]S’o = 4,0´10–3 mol.L-1
2.2.2. cL = 10´![]() (solution S0 diluée dix fois)
(solution S0 diluée dix fois)
cL = 10´4,0´10-3
= 4,0´10–2
mol.L-1
2.2.3. Si on ne diluait pas la solution
commerciale, l’absorbance serait non mesurable car cL
> [I2]max .
3. Étude cinétique d’une transformation chimique mettant en jeu l’eau
oxygénée et libérant du diiode
3.1. Un oxydant est une espèce chimique capable
de capter un ou plusieurs électrons.
3.2.
Couple àxydant réducteur :
H2O2(aq)
/ H2O(l)
½ équation de réduction
(car gain d’électrons) :
H2O2(aq) + 2 H+(aq) + 2 e– = 2 H2O(l)
ou :
H2O2(aq) + 2 H3O+(aq) + 2 e– = 4 H2O(l)
Couple oxydant
réducteur I2(aq) / I–(aq)
½ équation
d’oxydation car perte d’électrons :
2 I–(aq) = I2(aq) + 2 e–
3.3
|
.Relation stœchiométrique |
H2O2(aq) + 2 I–(aq) + 2 H3O+(aq)
= I2(aq)
+ 4 H2O(l) |
|||||
|
État du système |
Avancement |
Bilan de matière
en mol |
||||
|
État initial |
0 |
c2.V2 |
excès |
excès |
0 |
solvant |
|
Au cours de la
transformation |
x |
c2.V2
– x |
excès |
excès |
x |
solvant |
|
État final |
xf |
c2.V2
– xf |
excès |
excès |
xf |
solvant |
|
État final si la
transformation est totale |
xmax |
c2.V2
–xmax = 0 |
excès |
excès |
xmax = c2.V2 |
solvant |
3.4.
![]()
,
d'après le tableau
d'avancement nI2(t) = x(t). donc :
![]()
3.5 Vidéo .
![]()
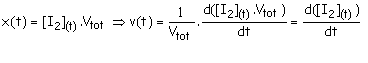
or
A(t) = k.[I2]t, soit [I2]t = A(t)/k
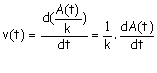
3.6.1. Vidéo
dA(t)/dt est la
dérivée de l’absorbance par rapport au temps. Cette dérivée est égale au coefficient directeur de la tangente à la
courbe à la date t.
Au cours du temps
les pentes des tangentes diminue, donc dA(t)/dt également.
La vitesse étant
proportionnelle à dA(t)/dt,
au cours du temps v(t) diminue.
Pour t1
> t0, la pente de la tangente diminue donc v0 > v1
t1/2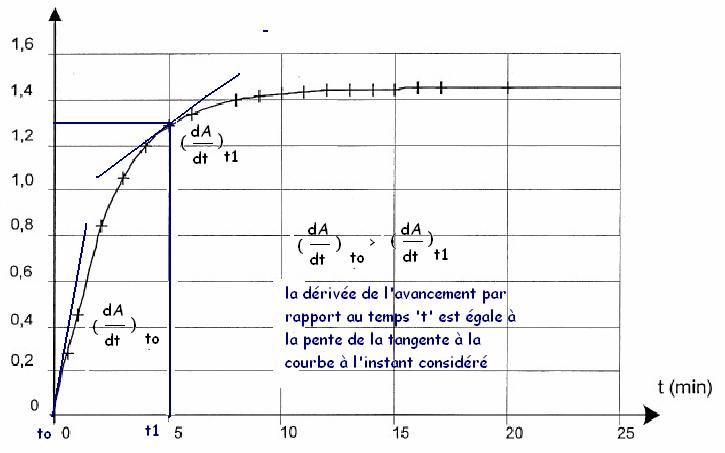
![]() 3.6.2.
Au cours du temps la
concentration en réactif diminue donc la vitesse de réaction diminue également.
3.6.2.
Au cours du temps la
concentration en réactif diminue donc la vitesse de réaction diminue également.
3.6.3
v(0) = 2,6x10-3
mol.L-1.min-1
3.7.1. Vidéo
Pour t > 20
min, A = Af
Graphiquement, Af = 1,45
or Af = k.[I2]f = k.xf/Vtot,
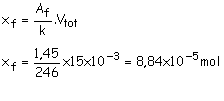
3.7.2. Exercice du chapitre 4:
voir la définition du tau d’ dans ce chapitre.
La solution de lugol a été diluée 10 fois :
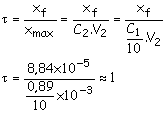
La transformation est totale car xf =
xmax.
3.8. Le temps de demi-réaction est la durée
nécessaire pour que l'avancement atteigne la moitié de sa valeur finale ;
x(t1/2
) = xf / 2.
L'avancement x est
proportionnel à l'absorbance : A = k.[I2]f = k.x/Vtot
pour x = xf alors A= Af,
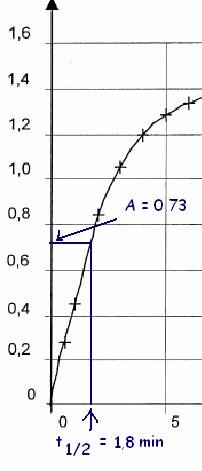
pour x( t1/2) = xf/2 alors A(t1/2)
= Af / 2.= 1,46 /2 = 0,73
Au
point d’ordonnée A(t1/2) correspond l’abscisse t1/2 = 2
min.
3.9.
Conclusion:
La transformation
chimique utilisée pour un titrage direct doit être totale et rapide.
La réaction H2O2(aq) + 2 I –(aq) + 2 H3O+(aq) = I2(aq) + 4 H2O(![]() )
)
est totale, mais
lente : on ne peut pas l’utiliser pour un titrage de l'eau oxygénée.