EXERCICE II : FERMENTATION DANS LE
VIN (Polynésie septembre 20056,5 points)
A – Premiere partie: Determination
du degre alcoolique d'un vin
« On appelle degré alcoolique d'une boisson
alcoolisée, le volume (exprimé en mL) d'éthanol contenu dans 100 mL de cette boisson,
les volumes étant mesurés à 20°C. »
On l'exprime en % vol.
I - Questions préliminaires
1.
½
réaction d’oxydation (perte d’électron)
CH3CH2OH = CH3CHO + 2H+ + 2e-
½ réaction de réduction (gain d’électron)
NAD+
+ H+ + 2e- = NADH
Couples
d'oxydo-réduction: CH3CHO / CH3CH2OH
NAD+ / NADH
2. Le catalyseur accélère la réaction sans intervenir dans son
équation bilan.
Il - Étalonnage du spectrophotomètre
1.
Si la solution de référence est de l’eau distillée, son absorbance doit
être nulle
2.
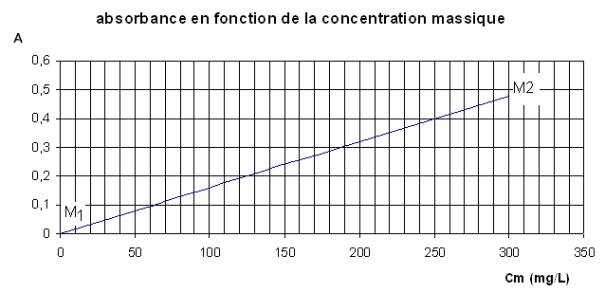
3. La courbe est une droite qui passe par
l’origine : l’absorbance est proportionnelle à la concentration massique
en éthanol : A = k.Cm
Pour déterminer le coefficient de proportionnalité k,
prendre 2 points de la courbe M1 et M2
M1(
Cm1 = O mg.L-1 ; A1 = O)
M2(Cm2
= 300 mg.L-1 , A2 = 0,48)
k =
1,6x10-3 L.mg-1
III - Préparation et dosage de l'éthanol
contenu dans le vin
1.
La concentration de la solution mère (solution D) est notée C. Le volume
prélevé est V = 1 mL
La solution fille a pour concentration C’ son volume
est V’ = 50 mL.
Au cours d’une dilution le nombre de mole de soluté se
conserve :
n = C.V = n’ = C’.V’
C’/C = V/V’ = 1/50
L’échantillon préparé correspond à une dilution au
1/50°.
On aurait pu également raisonner par rapport à la
masse d’éthanol. La masse d’éthanol contenue dans la solution mère est égale à
celle se trouvant dans la solution fille :
m = Cm.V = m’ = Cm’.V’
Cm’/Cm = V/V’ = 1/50
2.
.Utilisons la loi de Beer-Lambert :
A =
k.Cm
Ae
= 0,30
Cm =
Ae/k = 0,3/1,6x10-3 = 190 mg.L-1
Entre nous soit dit, on aurait pu utiliser la courbe. Aller,
on se laisse le loisir de le faire la prochaine fois. Et n’oublie pas : la
pire des maladies de l’homme est la
………peur ! (si tu trouves une relation entre Beer-Lambert et la
citation du jour, tu gagnes un point sur ta moyenne ).
3.
a) La concentration Cm de la solution D est :
Cm = 50.Cm’ = 50x100= 9,5 mg.L-1 = 9,5 g.L-1
b)
On distille V’’ = 20 mL de vin de concentration Cm’’ que l’on dilue dans une
fiole jaugée de volume V = 200 mL et de concentration Cm = 9,5 g.L-1
. Par conséquent la masse se conservant au cours de la dilution :
Cm.V
= Cm’’.V ‘’
Cm’’.V’’
= Cm.V
Cm’’ = Cm.V/V’’ = 9,5x200/20 = 95 g.L-1
4.
Degré alcoolique du vin.
MV = 0,80 kg.L-1 = 800 g.L-1
= m/V
D’après la question précédente 100 mL de vin contient
9,35 g d’éthanol. Cette masse correspond à un volume V tel que :
V = m/MV = 9,5/800 = 0,0117 L = 12 mL.
Le degré alcoolique correspond au volume d’éthanol
contenu dans 100 mL de vin : le degré alcoolique est de 12 %
B – Deuxieme partie:
cinetique de la fermentation malolactique
[acide malique] (t) = n acide malique (t = 0) / V = macide
lactique / (M.V) = Cm / M
La formule brute de l’acide lactique (COOH-CH2-CHOH-COOH)
est : C4H6O5
La masse molaire moléculaire de l’acide lactique est :
M =4.MC + 6.MH + 5.MO = 134 g.mol-1
La concentration molaire de l’acide lactique est :
![]()
Quantité
de matière d'acide malique n acide malique (t = 0) initiale dans un
litre de vin.
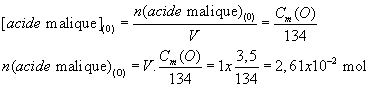
2.
|
Réactif/produits |
COOH-CH2-CHOH-COOH (Acide malique ) |
CH3-CHOH-COOH (Acide lactique) |
CO2 |
|
Avancement x = 0, t = 0 |
2,6x10-2 |
0 |
0 |
|
Avancement x, instant t |
n(acide malique)t = 2,6x10-2 –
x(t) |
x(t) |
x(t) |
D’après le tableau d’avancement
x(t) = 2,6 x 10–2 – n acide malique (t)
3. La courbe représentant les variations de x en fonction du
temps t est donnée en annexe. Le volume de vin est V =1L
a)
Evaluer la vitesse
volumique de réaction à l'instant t = 0
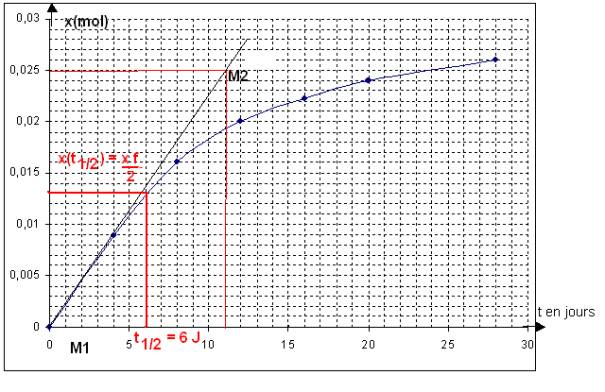 Pour
déterminer la vitesse de la réaction à l’instant ‘t = 0 ’
Pour
déterminer la vitesse de la réaction à l’instant ‘t = 0 ’
1)
tracer la tangente à la
courbe à l’instant t =0
2)
déterminer la pente de
cette tangente en prenant 2 points, puis diviser le résultat obtenu par le
volume de solution.
M1( x1 = 0 mol ; t1 = 0 J)
M2( x2 = 0,025 mol ; t2 = 11 J)
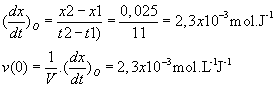
b) Vidéo
La vitesse volumique de la réaction est
proportionnelle à la dérivée de l’avancement par rapport au temps.
Or la dérivée de l’avancement par rapport au temps ![]() est égale à la pente de la tangente à la courbe au cours du temps.
Cette pente diminue. Par conséquent la vitesse diminue au cours du temps.
est égale à la pente de la tangente à la courbe au cours du temps.
Cette pente diminue. Par conséquent la vitesse diminue au cours du temps.
3. Le temps demi-réaction t1/2 est la durée
au bout de laquelle l’avancement est égal à l’avancement final divisé par 2 :
x(t1/2) = xf/2
Graphiquement t1/2 = 6J
Données: MC = 12 g.mol-1; MO = 16 g.mol-1 ; MH = 1,0 g.mol-1