d) Le taux d’avancement final est égal au
rapport de l’avancement final sur l’avancement maximal :
![]()
Il représente le pourcentage de molécules
d’acide ayant réagit avec l’eau
![]()
![]()
![]()
Conclusion : l’acide 1 est moins dissocié que l’acide 2 pour lequel
la réaction avec l’eau est totale.
Q3
a)
Vidéo
La pente de la tangente à la courbe à l’instant t, est égale à la vitesse volumique de la réaction. En effet :
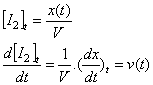
Comme la pente diminue au cours du temps, la
vitesse volumique diminue également au cours du temps.
b) La vitesse de réaction est maximale quand
la pente de la tangente à la courbe est maximale. C’est le cas à t = 0 :
vmax = v(t = 0)
c) Vidéo
Au temps de demi-réaction t1/2
l’avancement x(t1/2) est égale à l’avancement finale( maximale si la
réaction est totale) divisée par 2 :
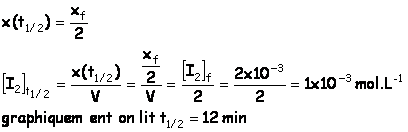
c) Vidéo
Détermination graphique de la vitesse
volumique :
v(t1/2) est égale à la pente de la
tangente à la courbe à l’instant t1/2.
Pour la déterminer on prends 2 points de la
tangente et on détermine graphiquement leurs coordonnées :
M1 ( t1 = 0 min ; [I2]t1
= 0,3 x 10-3 mol.L-1) M2
(t2 = 28 min ; [I2] t2 = 1,9 x 10-3 mol.L-1)
![]()
Q4
a) Les 2 couples redox sont : H2O2
/ H2O et I2
/ I-
b) Demi-équation d’oxydation demi-équation de réduction
H2O2 + 2H+ +
2 e- = 2 H2O 2I-
= I2 + 2 e-
c) Les ions iodures subissent une oxydation
car il perdent chacun un électron.
d) L’espèce chimique HA correspondant à un
taux d’avancement final maximal (égale à 1) est l’ion oxonium H3O+
Q5
a) Vidéo
V = 0,2 L ; sexp = 53,4 mS.m-1
s = lA-. [A-] + l H3O+ . [H3O+] (1)
(les ion HO- sont négligés car on se trouve en milieu acide
et que leur concentration est négligeable devant celles des autres ions)
a)
Vidéo
D’après la relation 1 :
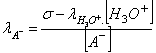
[A-]1 = [H3O+]1
= 1,3 x10-3 mol.L-1 = 1,3 mol.m-3
![]()
c) La valeur de l qui se rapproche le plus de la valeur de lA- est celle de l’ion méthanoate
(lHCOO- = 5,46 mS.m2mol-1)
L’acide recherché est l’acide méthanoïque.