A propos de l’aspirine (bac 2004) énoncé
Q1
a) Le pH de la solution vaut 2,9.
La relation entre les ions oxonium et la
valeur du pH est :
![]()
b) Equation de la réaction entre l’acide
acétylsalicylique (AH) et l’eau :
AH(aq) + H2O(l)
= A-(aq) + H3O+(aq)
c)
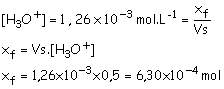
Q2
a) L’avancement maximal correspond au cas
ou la réaction est totale. La quantité de matière de réactif en défaut (AH) est
alors nulle :
![]()
b) Le taux d’avancement final est égal au
rapport entre l’avancement final et l’avancement maximal.
![]()
c) La réaction n’est pas totale car le
taux d’avancement final est inférieur à 1. L’avancement final est inférieur à
l’avancement maximal.
![]()
Remarque : si la réaction est totale
l’avancement final est égal à l’avancement maximal, le taux d’avancement final
est égal à 1.
Q3
a) Réponse partielle, pour voir la
correction vidéo clique
ici.
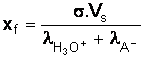
b) Réponse partielle, pour voir la
correction vidéo clique
ici.
xf = 5,70 x 10-4
mol
c) Concentrations molaires des espèces
chimiques à l’équilibre.
D’après le tableau d’avancement :
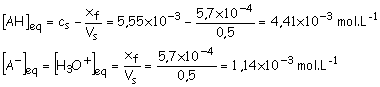
d)
Réponse partielle, pour voir la correction vidéo clique
ici.
![]()
Q4
La pH-métrie est moins précise que la conductimétrie.
En effet, on observe un écart beaucoup plus important de la
valeur de xf en pH-métrie qu’en conductimétrie.
En pH-métrie : 5 x 10-4 mol < xf < 7,9 x 10-4
mol
En conductimétrie : 5,6 x 10-4 mol < 5,8 x 10-4
mol
Conclusion : il faut utiliser le conductimètre pour
déterminer la valeur de l’avancement final xf.