Chapitre 4 : équilibre chimique, constante de réaction et d’équilibre
Taux d’avancement final et conductimétrie
1) Equation de la
réaction modélisant la transformation entre l’acide acétique et l’eau :
CH3CO2H(aq) + H2O(l)
= CH3CO2- (aq) + H3O+(aq)
2) L’expression de
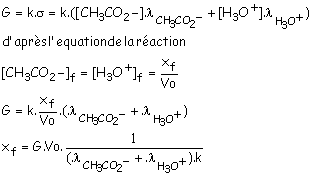
la conductance de la solution est :
![]()
3)
a) Si la concentration
co augmente, la concentration
en ions acétate et oxonium va augmenter, la
conductance également.
b. le volume V0 de la solution ne
va pas modifier la concentration co dans le bécher donc la
concentration en ions : la
conductance ne va pas varier
c. La variation de température va modifier la valeur de xf
et des conductivité molaire ionique ![]() donc la concentration des produits. La conductance va varier.
donc la concentration des produits. La conductance va varier.
4) Relation entre G et l’avancement
final xfinal. Calculer la
valeur de xfinal en mol.
G = 11,5 µs
5)
G = 11 µS = 11x10-6 S ; l = 3,5 x 10-2 S.m².mol-1 ; l’ = 4,1 x 10-3 S.m².mol-1 ; k = 2,5 x 10-3 m ;
Vo = 10-4 m3
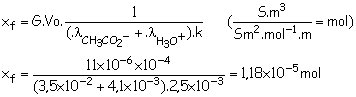
6) Taux
d’avancement final :
xmax = co.Vo
= 10-3.0,1 = 1,0x10-4 mol
![]()
7) La transformation n’est pas totale car ![]()