ANALYSE D’UN LAIT (Antilles 2006 ;
6,5 points)
On
se propose de déterminer les masses en ions chlorure et en acide lactique
présents dans un lait.
1.
DOSAGE PAR CONDUCTIMÉTRIE.
1.1. La
quantité de matière se conserve au cours d’une dilution. Le nombre de mole de
lait de la solution mère no = Co.Vo est
égal au nombre de mole de lait dans la solution fille ns = CS.Vs
Co.Vo = Cs.VS
![]()
1.2.
1. On verse la solution S dans un bécher
(ne jamais prélever directement dans la solution mère sous peine de la
souiller).
2.
on prélève les 10 mL de solution S avec une
pipette jaugée de 10 mL surmonté d’un pipeteur (de couleur rouge rose ou jaune suivant sa
sensibilité )
1.3.
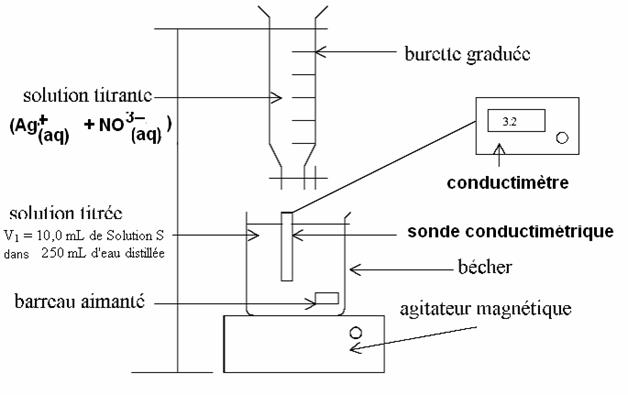
1.4
Origine
de la conductivité initiale de la solution :
La
solution contenait initialement des ions chlorure et évidemment des ions H3O+
et HO- comme dans toute solution aqueuse.
1.5
variation
de la valeur de la conductivité :
Expression
de la conductivité (on néglige les autres ions de la solution, ils sont en
concentration trop faible) :
![]()
Equation
de dosage:
Ag+(aq) + NO3–(aq)) + Cl–(aq) = AgCl(s) + NO3–(aq)
Avant
l’équivalence :
Les
ions chlorures sont consommés, leur concentration diminue.
La
concentration en ions argent est quasi nulle.
La
concentration en ions nitrate augmente. A chaque fois qu’un ion chlorure réagit
un ion nitrate tombe dans le bécher. C’est comme ci un ion nitrate remplaçait
un ion chlorure. Comme les ions chlorure ont une meilleure conductivité molaire
ionique, la conductivité diminue.
Après
équivalence.
Il
n’y a plus d’ions chlorure.
La
concentration en ion argent et nitrate augmente., donc la conductivité
augmente.
À 25°C : l(Cl–(aq)) =
76,3´10-4 m².S.mol-1
l(NO3–(aq)) = 71,4´10-4
m².S.mol-1
l(Ag+(aq)) = 61,9´10-4
m².S.mol-1
1.6
Quand
la pente change de signe, on se trouve au point équivalent. Les réactifs sont introduits
dans les proportions stœchiométriques.
1.7.
Le
volume V2E = 12 mL
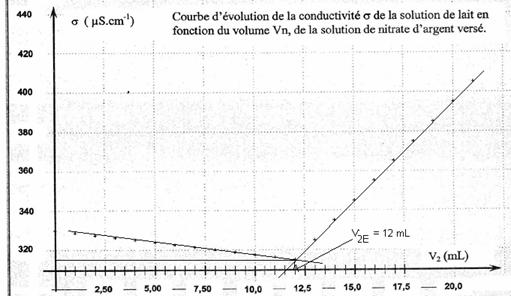 1.8.
Quelle est à l’équivalence la relation
entre la quantité de matière en ions argent introduits et la quantité de
matière en ions chlorure initialement présents ?
1.8.
Quelle est à l’équivalence la relation
entre la quantité de matière en ions argent introduits et la quantité de
matière en ions chlorure initialement présents ?
Les
réactifs sont introduits dans les proportions stœchiométriques :
n(Ag+(aq))versé = n(Cl–(aq))initial
1.9
n(Ag+(aq))versé = n(Cl–(aq))initial
C2.V2E
= n(Cl–(aq))initial
= CS.V1
![]() .
.
![]()
D’après
la question 1.1. on a :
![]()
![]()
avec ![]()
![]()
1.10. Masse d’ions chlorure
présents dans le lait étudié et conclure.
t
= C0.M(Cl–) = 3,00x10-2 x35,5
t
= 1,07 g.L–1
La
masse d’ion chlorure dans un litre de solution est de 1,07g. Elle est bien comprise entre 1,0 g et 2,0 g par
litre de lait.
2. DOSAGE DE L’ACIDE LACTIQUE
2.1.
Equation
de la réaction qui se produit lors du mélange.
HA(aq) + HO–(aq) =
A–(aq) + H2O(l)
Une réaction de dosage doit être rapide et
totale.
2.2.
Constante
d’acidité correspondant au couple H2O/HO–(aq)
2
H2O(l) = H3O+(aq) + HO–(aq) KA1 = [H3O+(aq)].[HO–(aq)]
Constante
d’acidité correspondant au couple HA(aq)/A–(aq)
HA(aq) + H2O(l) = A–(aq) + H3O+(aq)
KA3 = 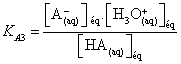
Constante de réaction K
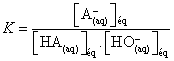
En multipliant K par l’expression suivante
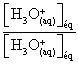
On
obtient :
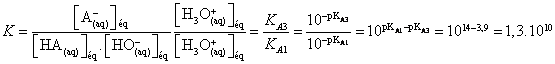
K >> 103
la réaction est quasi totale.
2.3.
Au
début du dosage, pH = 2 ,9
D’après
le diagramme de prédominance ci dessous l’’espèce prédominante est HA(aq).

2.4.
On a pH = pKA3 + log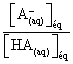
utilisant un diagramme de
prédominance, déterminer quelle est, entre HA(aq)
et A–(aq) l’espèce chimique
prédominante au début du dosage.
2.4.
Pour
quel volume de soude versé, HA(aq) et A–(aq) sont-elles présentes en quantités égales ?
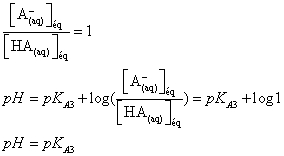
La
relation liant le pKA le pH et les
concentrations d’acide et de base est :
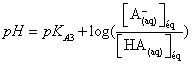
Lorsque
l’acide et la base sont en concentration égale alors :
D’après le tableau de
valeur le volume de base versé est alors Vb = 6 mL
2.5. A l’équivalence les réactifs ont été
introduits dans les proportions stœchiométriques :
nHA = nHO-(versé)
nHA = CB.VBE
nHA = 5,00´10–2 ´12,0´10-3
= 6,00´10–4 mol
Dans VA = 20,0 mL de lait, il y a 6,00´10–4 mol d’acide lactique.
2.6
La
concentration massique en acide lactique du lait est :
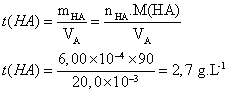
tHA =
= 2,7 g.L–1
> 1,8 g.L–1 donc le lait n’est pas
frais la faute à qui ?