DU CHOU DANS L'abricot
(Antilles 09-2007, 4 points )
1. ÉTUDE DU DOSAGE
1.1. Réaction de dosage entre
l’acide propanoïque et l’hydroxyde de sodium :
CH3–CH2–COOH(aq) + Na+aq
+ HO–(aq) = CH3–CH2–COO–(aq) + H2O(l) + Na+aq
Equation simplifiée :
CH3–CH2–COOH(aq) + HO–(aq)
= CH3–CH2–COO–(aq)
+ H2O(l)
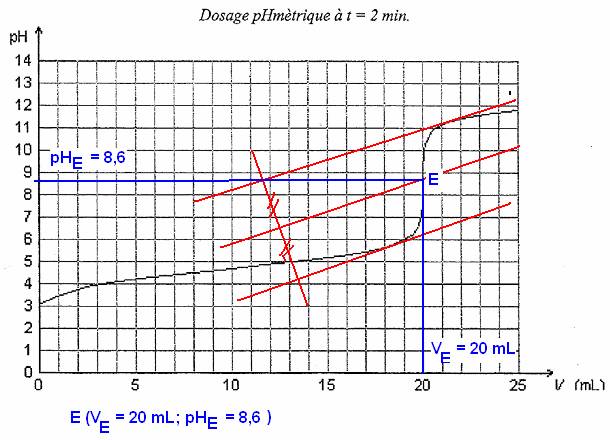
1.2. On utilisera la méthode des tangentes :
1) Tracer 2 tangentes à la
courbe, parallèles entre elles, de part et d'autre du point d'équivalence.
2) Tracer la parallèle
équidistante de ces deux tangentes.
3) l'intersection de cette
parallèle avec la courbe pH=f(Vb) donne le point d'équivalence E(VbE;pHE).
1.3.
Espèces chimiques |
Cation
Flavyliun Base Quinonique |
Chalcone |
||
|
pH |
3,0
6 8,5 13 |
|||
|
Couleur |
rouge |
Bleu vert |
Vert
|
Jaune |
Au démarrage du dosage le pH vaut environ pH = 3.
D’après l’annexe 3, à ce pH, le jus de chou est rouge.
1.4. Avant l’équivalence à pH = 6
la solution est bleu puis elle change de couleur en virant au vert à
l’équivalence : on peut utiliser le jus de chou pour repérer
l’équivalence.
1.5. Utilisation de la courbe
pour déterminer la constante d'acidité de l'acide propanoïque :
1.5.1 CH3CH2COOH(aq) + H2O(l) = CH3CH2COO–(aq) + H3O+
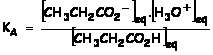
1.5.2. Pour un volume V = VE tout l’acide
propanoïque AH est consommé.
Pour un volume V = ![]() , la moitié de la quantité initiale d’acide propanoïque est
consommée :
, la moitié de la quantité initiale d’acide propanoïque est
consommée :
n(AH) (1/2 équivalence) = n(AH)initiale/2
La quantité de matière d’ion propanoate formé est n(A-)formé = n(AH)initiale/2
Par conséquent les concentration
en acide et en ion propanoate sont égale:
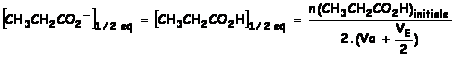
avec Va : volume d’acide
initiale à doser
1.5.3. ![]()
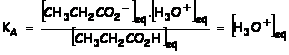
[H3O+] = 10-pH
donc lorsque
la moitié du volume équivalent a été versé :
KA
= 10–pH
1.5.4. Pour V = 10 mL, on lit sur pH = pKA = 4,8
Donc KA =10-pKa=
10-4,8 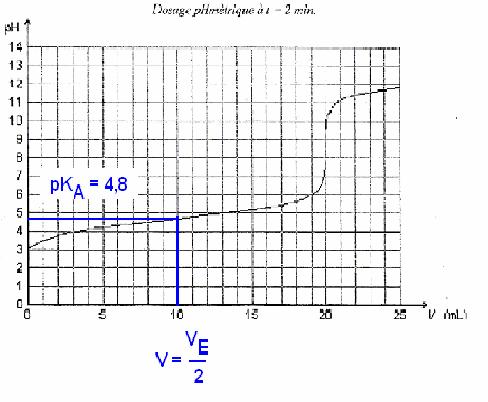 l’annexe
4, pH = 4,7. Alors KA = 10–4,7 = 2,0.10–5.
l’annexe
4, pH = 4,7. Alors KA = 10–4,7 = 2,0.10–5.
2.SUIVI
TEMPOREL DE LA SYNTHÈSE.
2.1. La trempe permet de stopper la réaction
d’estérification. Dans l’échantillon prélevé, le mélange réactionnel n’évolue
plus on peut doser l’acide propanoïque restant à
l’instant ‘t’ du prélèvement.
2.2.À t = 0 s, VB = 29,0
mL d'acide propanoïque (CH3CH2CO2H)
Masse volumique r = 0,99 g.mL-1 ;
masse molaire M = 74,0 g.mol–1
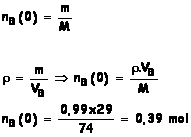
nB(0)
= ![]() = 0,39 mol d’acide
propanoïque initialement. 0,125 pt
= 0,39 mol d’acide
propanoïque initialement. 0,125 pt
2.3. Si l’alcool A est le réactif
limitant alors nA(0) – xmax
= 0 soit xmax = nA(0)
donc xmax = 0,18 mol
Si l’acide propanoïque B est
limitant alors nB(0) – xmax
= 0 donc xmax = 0,39 mol.
0,25 pt Le réactif limitant est celui qui conduit à l’avancement
maximal le plus faible, il s’agit de l’alcool A et xmax
= 0,18 mol.
2.4. 0,125 pt nB = nB(0) – x
2.5. Quantité n’B d'acide
propanoïque présent dans la prise d'essai à la date t = 30 min, à
cette date V = 13,0 mL de réactif titrant :
D’après l’équation support du
titrage (cf. 1.1.), à l’équivalence n’B = ![]() versée
versée
0,125pt n’B = C.V
0,125pt n’B = 1,0 ´ 13,0´10–3 = 1,3´10–2 mol d'acide propanoïque dans la prise
d'essai à t = 30 min
Quantité nb d'acide propanoïque restant dans le milieu réactionnel de
volume VT
= 50,0 mL
Par proportionnalité, on a nB = n’B.![]()
0,125pt nB = 1,3´10–2´![]() = 0,22 mol
= 0,22 mol
2.6. 0,25 pt D’après 2.4. nB(t) = nB(0)
– x(t) donc x(t) = nB(0) – nB(t)
t(t) = ![]()
t(t) = ![]() = 0,95 soit t = 95% à la date t = 30 min
= 0,95 soit t = 95% à la date t = 30 min
Calcul effectué avec les valeurs
non arrondies de nB(0) et nB(t)
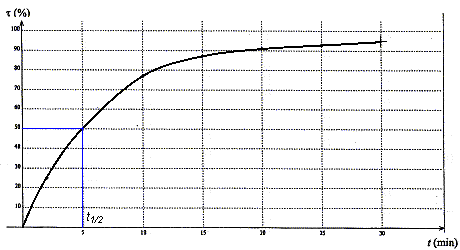
2.7. 0,125 pt
0,125 pt
D’après le tableau, V(25min) =
V(30min) donc t(25min)
= t(30min). Ce qui
indiquerait que la transformation est terminée.
Pourtant sur le graphique, on
remarque que t(30) > t(25min).
Si on se fie au graphique, le
taux d’avancement ne semble pas encore constant à la date t = 30 min, on en
déduit que la transformation n’est pas tout à fait terminée.
2.8. Le temps de demi-réaction
est la durée nécessaire pour que l’avancement atteigne la moitié de sa valeur
finale : x(t1/2) = xfinal
/2.
0,125pt Si on considère que la transformation est
totale alors xfinal = xmax
donc t(t1/2)
= ![]() = 0,50 = 50%.
= 0,50 = 50%.
0,125pt Graphiquement on
détermine t1/2 = 5 min.