Chapitre 6 : réaction acido-basique, titrage
Injections alcalinisantes (Bac Nouvelle Calédonie
2003)
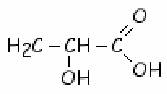
Q1
a)
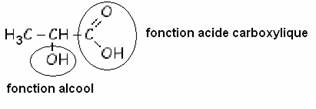
b) Vidéo
Ion lactate :
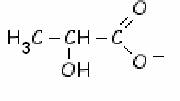
Q2
V1 = 20,0 mL de solution S de lactate de sodium solution d'acide chlorhydrique H3O+(aq)+Cl-(aq) de concentration molaire en soluté apporté C2 = 1,0 mol.L-1 .
a) Equation de titrage :
A-aq + H3O+(aq) =
AH aq + H2O
b) Le point équivalent correspond au point de
la courbe dpH/dV2 = f(V2)
ayant l’ordonnée la plus faible.
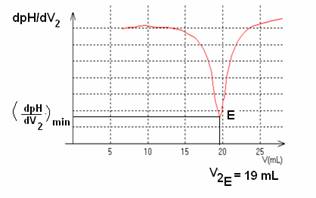
Graphiquement V2E
= 19 mL
c) A l’équivalence les réactifs ont été introduits dans les proportions stœchiométriques
C1V1
= C2.V2E
C1
= C2.V2E / V1 = 1x19/20 = 0.95 mol.L-1
Q3
a)
C2 = 1,0 mol.L-1 ; V2 = 9,0x10-3
L Quantité de matière d’ions oxonium introduite :
a)
n(H3O+) = C2V2
= 1,0x9,0x10-3 = 9x10-3 mol
b)
c)
b)
Vidéo
d)
Attention
le volume totale de solution est V1 + V2 = 29 mL !!
e)
n(H3O+) = [H3O+]/V
= 10-pH/(V1 + V2) = 10-4x29x10-3
=2,9x10-6 mol .
c) La transformation peut être considérée comme totale en effet initialement n(H3O+) = 9x10-3 mol et en fin de réaction n(H3O+) =2,9x10-6 mol (il reste moins d’un millième des ions initialement présent dans la solution)
Q4
a) Vidéo
HCO3-aq + H3O+aq = (CO2, H2O)aq
+ H2O
b) Les ions H30+ sont consommés, leur concentration diminue, le pH augmente.
c)
![]()
La réaction est quasi-totale !