Réactions acido-basiques (Afrique 2003)
1.1 Vidéo
HInd + H2O = Ind– + H3O+
C0 =
2,90.10-4 mol.L-1
[H3O+]
= 6,6.10-5 mol.L-1
V=100 mL
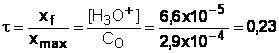
t < 1 la réaction n’est pas totale, l’acide n’est pas totalement dissocié dans l’eau
1.2 Expression de la constante d’acidité KA de la réaction
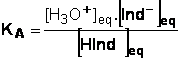
1.3 KA=1,9.10-5.
pKA = -log KA = - log 1,9 x 10-5 = 4,7. Il s’agit du vert de bromocresol.
2.1 Réaction de dosage :
H3O+ aq + Cl- aq + Na+aq + HO-aq = 2 H2O(L) + Cl- aq + Na+aq
Equation simplifiée :
H3O+
aq + HO-aq = 2 H2O(L)
2.2 A l’équivalence la valeur de la conductance est la plus faible. On lit sur le graphique VE = 11 mL.
2.3 A l’équivalence les réactifs ont été introduits dans les proportions stoechiométriques.
C1V1
(initial)
= CB.VE
C1
= CB.VE / V1
= 1,00 x10-1 x 11/100 = 1,1 x 10-2 mol.L-1
2.4 La solution So est 1000 fois plus concentrée :
Co = 103
.C1 = 11 mol.L-1
2.5 Vidéo
Co = no
/ V = mo / (M.V) . On prend V = 1L
mo = Co . M.V = 11 x 36,5 x 1 = 4,O x 102 g
2.6 Vidéo
Pourcentage massique :
![]()
¨La bouteille indique un pourcentage de 33% en masse d’acide chlorhydrique, l’indication portée sur l’étiquette est correcte.
2.7 Couleur de la solution
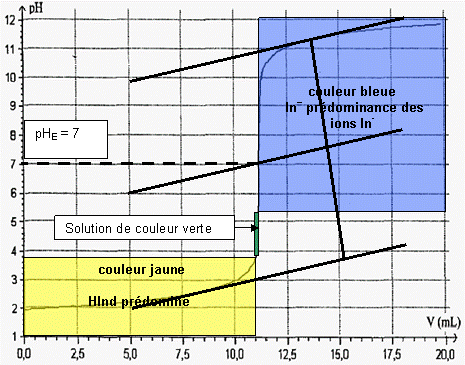
2.8 Le bleu de bromothymol aurait été mieux adapté car le pHE est compris dans sa zone de virage. A l’équivalence la solution aurait été de couleur verte.