Réactions en solution aqueuse (Ministère) énoncé
Q1
a) Le produit ionique Ke de l’eau
est égal au produit des concentrations en ions oxonium (H3O+)
et hydroxyde (HO-).
Remarque : Ke est une constante
d’équilibre, par conséquent les concentrations des ions sont mesurés à
l’équilibre (notation ‘eq’ en indice).
Ke = [H3O+]eq .[HO-]eq
b) Réponse partielle, pour voir la vidéo clique
ici.
Ke = 10-14
Q2
a) Equation de la réaction
entre l’acide éthanoïque et l’eau (ne pas oublier de noter en indice, dans quel
état se trouvent les espèces chimiques).
CH3CO2H (aq) + H20
(l) = CH3CO2-
(aq) + H3O+ (aq)
b) Réponse partielle, pour voir la correction vidéo clique
ici.
L’acide éthanoïque prédomine à pH = 3,2.
Q3
a) Réponse partielle, pour voir
la correction vidéo clique
ici.
xf1 = 6,3 x 10-6 mol
b) D’après le tableau d’avancement, si la réaction était
totale, il n’y aurait plus d’acide éthanoïque dans le bêcher :
C1 - xmax1/V1 = O
xmax1 / V1 = C1
xmax1 = C1.V1 = (2 x 10-2 ) x
(10-2) = 2 x 10-4
mol.
On remarque que l’avancement final est inférieur à l’avancement
maximal, et que par conséquent la réaction n’est pas totale.
xf1 = 6,3 x 10-6 mol < xmax1
= 2 x 10-4 mol , la réaction est partielle.
c) Le taux d’avancement final est égal au rapport entre
l’avancement final et maximal :
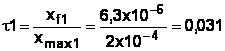
d) Réponse partielle, pour voir la correction vidéo clique
ici.
Le taux d'avancement final étant de 3%, seulement 3% des
molécules d'acide ont réagi. L'acide éthanoïque reste prépondérant par rapport
à l'ion éthanoate.
Q4
a) Réponse partielle, pour voir la correction vidéo clique
ici.
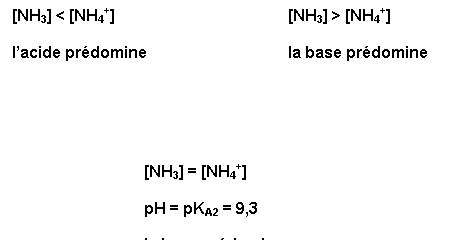
A pH = 10,6, la
concentration en ammoniaque NH3 est supérieure à la concentration en
ion ammonium, en effet pH > pKA2 .
c) Réponse partielle, pour voir
la correction vidéo clique
ici.
Q5
a) Réponse partielle, pour voir la correction vidéo clique
ici.
Qr(i) = 0
b) Réponse partielle, pour voir la correction vidéo clique
ici.
Qr(i) < Qr(eq) , le sens d’évolution
spontané de la réaction est dans le sens direct.
c) Expression du Qreq
en fonction de l'avancement final. D'après le tableau d'avancement :
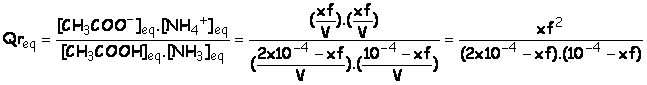
d) Réponse partielle, pour voir la correction vidéo clique
ici.
La réaction peut être considérée comme totale, car sa
constante d’équilibre est très supérieure à 103
Le pH = 4,7 car les concentrations finales en acide
éthanoïque et ion éthanoate sont égales.