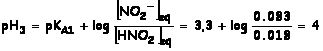ph d’un mélange – (2006 Liban 4 points) énoncé
I – ÉTUDE DE DEUX
SOLUTIONS
I.1.
a) Réaction entre l’acide
nitreux et l’eau :
HNO2(aq) + H2O(l) = NO2–(aq) + H3O+(aq)
La
constante d’équilibre K de la réaction est appelé constante d’acidité . En
effet il s’agit de la réaction entre un acide et l’eau :
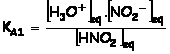
Ne
pas oublier l’indice ‘eq’ qui signifie concentration à l’équilibre.
I.1.
b) Réaction entre l’ion méthanoate et l’eau
HCOO–(aq) + H2O(l) =
HCOOH(aq) + HO–(aq)
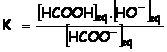
I.2. a) pH = pKa l'acide
et sa base conjuguée ont même concentration
pH> pKA la base prédomine
pH < pKA l’acide prédomine
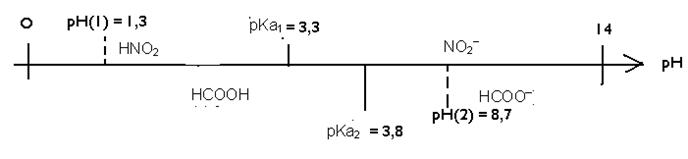
I.2. b) D’après le domaine de prédominances des espèces
chimiques :
Solution d’acide nitreux : pH =1,3 ;
l’espèce prédominante est l’acide nitreux HNO2(aq).
Solution de méthanoate de sodium : pH =
8,7 ; l’espèce prédominante est l’ion méthanoate HCOO–(aq).
II – ÉTUDE D'UN MÉLANGE DE CES SOLUTIONS
II.1. a) Réaction entre l’acide nitreux et l’ion méthanoate :
HNO2(aq)
+ HCOO–(aq) =
NO2–(aq) +
HCOOH(aq)
II.1. b) Vidéo
Expression du quotient de
réaction initiale :
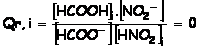
![]()
II.1.
c) Vidéo
Quotient de réaction à l’équilibre ou constante
d’équilibre :
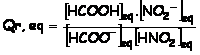
On
multiplie l’expression de Qr,eq par [H3O+]eq pour
faire apparaître les constante d’acidité des 2 couples
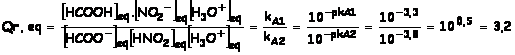
II.1. d) Vidéo
Qr,i < Qr,éq
La réaction se déroule dans le sens direct.
|
II.2. a) Équation |
HNO2(aq) + HCOO–(aq) = NO2–(aq) + HCOOH(aq) |
||||
|
État du système chimique |
Avancement (mol) |
Quantités de matière (mol) |
|||
|
n(HNO2)) |
n(HCOO–)) |
n(NO2–)) |
n(HCOOH)) |
||
|
État initial |
x = 0 |
n1 |
n2 |
0 |
0 |
|
État intermédiaire |
X |
n1 – x |
n2-x |
x |
x |
|
État d’équilibre |
x = xéq |
n1 – xéq |
n2 – xéq |
xéq |
xéq |
II.2. b)
xéq = 3,3
´
10-2 mol ; attention le volume du mélange est 2V
![]()
![]()
![]()
II.2. c) Calcul du quotient de réaction à l’équilibre
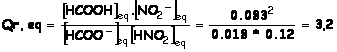
Les valeurs obtenues
sont identiques Qr,éq = 3,2
II.3. Vidéo
Pour le couple HNO2(aq)
/ NO2–(aq) :