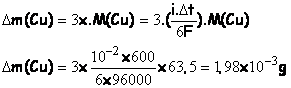BAC 2004 Antilles
EXERCICE II- (2,5 points) Calculatrice autorisée
DURÉE DE FONCTIONNEMENT D’UNE PILE CUIVRE – ALUMINIUM
1. Schéma annoté de la pile.
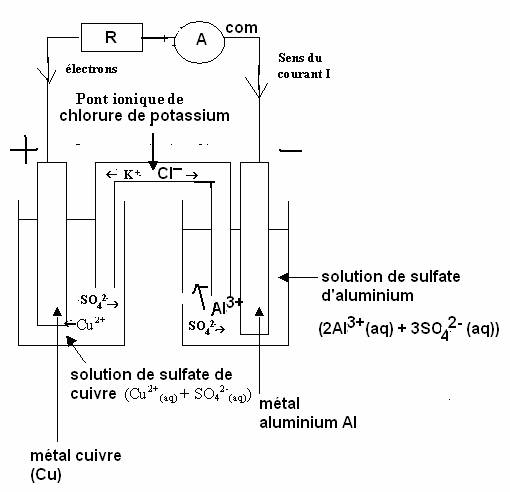
2. L’ampèremètre indique que le courant circule de la plaque de cuivre vers la plaque d’aluminium à l’extérieur de la pile. Par conséquent la borne positive est la plaque de cuivre. En effet, dans un générateur, le courant circule de la borne positive vers la borne négative. Les anions se déplacent dans le même sens que les électrons. Les cations se déplacent dans le sens du courant électrique.
- L’équation d’oxydoréduction de fonctionnement de la pile est :
3 Cu2+(aq) + 2Al(s) = 3 Cu(s) + 2 Al3+(aq) (1)
A l’électrode de cuivre (+), il se produit une réduction, c’est à dire un gain d’électrons :
Cu2+(aq) + 2 e– = Cu(s)
A l’électrode d’aluminium (–), il se produit une oxydation donc libération d'électrons:
Al(s) = Al3+(aq) + 3 e–
- La constante d’équilibre associée à l’équation (1) est K = 10200.
4.1. Déterminer le quotient initial de réaction du système ainsi constitué.
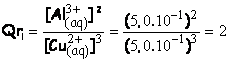
4.2. Le sens d’évolution du système étudié est cohérent. En effet Qri < K par conséquent la réaction à lieu spontanément dans le sens directe.
5.1.
n(Cu2+)i
= [Cu2+(aq)]ini ´ V = 5,0.10–1 ´ 50.10–3 = 2,5.10–2
mol
nAl ini = ![]()
|
Équation |
3 Cu2+(aq) + 2 Al(s) = 3 Cu(s) + 2 Al3+(aq) |
||||
|
État du système |
Avancement (mol) |
Quantités de matière (mol) |
|||
|
État initial |
0 |
2,5.10–2 |
3,7.10–2 |
14.10–2 |
2,5.10–2 |
|
En cours de transformation |
x |
2,5.10–2 – 3x |
3,7.10–2 – 2x |
14.10–2 + 3 x |
2,5.10–2 + 2x |
Détermination du réactif limitant :
2,5.10–2 – 3xmax = 0 soit xmax = 8,3.10–3 mol
3,7.10–2 – 2xmax = 0 soit xmax = 19.10–3 mol
Le réactif limitant est celui qui conduit à l'avancement maximal le plus faible, c'est Cu2+ :
xmax = 8,3.10–3 mol.
5.2 Quantité maximale d’électricité que peut débiter cette pile.
La pile s’arrête de fonctionner
quand il n’y a plus d’ions cuivre (réactif limitant) donc quand x = xmax
3 Cu2+(aq) + 2Al(s)
+6e- = 3 Cu(s) + 2 Al3+(aq) + 6e-
La quantité de matière ayant circulé dans les fils en fin de réaction vaut d’après l’équation bilan :
n(e-) = 6xmax

5.3
La quantité d’électricité débité est :
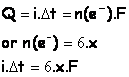
La variation de quantité de matière de métal cuivre est :
![]()
La variation de masse de métal cuivre est :