A propos du zinc (Bac USA 2005) énoncé
Q1
a)
A la cathode (reliée à la borne – de la pile) réduction : Fe2+(aq) + 2 e– = Fe(s)
A l’anode (reliée à la borne + de la pile ) oxydation:
Zn(s) = Zn2+(aq)
+ 2 e–
b)
Déterminations des quantités de matière de réactifs initiaux :
n(Fe2+)i = c1.V1
= 1,00´10–1 ´ 0,100 = 1,00´10–2
mol
n(Zn2+)i = c2.V2
= 1,00´10–1 ´ 0,200 = 2,00´10–2
mol
Q2
 a) équation (1) Fe2+(aq) +
Zn(s) = Zn2+(aq) + Fe(s)
a) équation (1) Fe2+(aq) +
Zn(s) = Zn2+(aq) + Fe(s)
n(Fe2+)i
=1,00´10–2 mol; n(Zn2+)i
= 2,00´10–2 mol

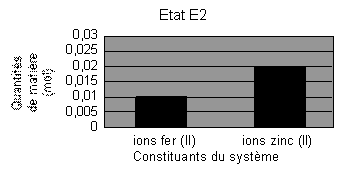
Cet état correspond à la figure 2 ci dessus.
b) Critère d’évolution spontané
:
Si Qr,i
< K le système évolution dans le sens direct de l’équation bilan (de
« gauche à droite » )
Si Qr,i > K le système évolue dans le sens
indirect de l’équation bilan
Si Qr,i = K le système n’évolue pas, l’état
d’équilibre est atteint.
Qr,i = 2 ; K = 1,4 x 1011 Þ Qr,I
< K le système évolue dans le sens
direct de l’équation bilan
c) Calcul
des quotients de réaction.
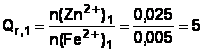
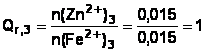
d) Au cours de la réaction Qr,i = 2 va augmenter
et tendre vers K.
Seul Qr,1 correspond à un état intermédiaire,
car il est compris entre Qr,i et K.
Q3
a) Tableau d’avancement
|
|
Avancement (mol) |
Équation de la réaction |
|||
|
Fe2+(aq) + Zn(s) = Zn2+(aq) + Fe(s) |
|||||
|
Etat Initial |
x = 0 |
n(Fe2+)i = 0,010 |
|
n(Zn2+)i = 0,020 |
|
|
Etat final |
x = xf = 0,010 |
0,010 - xf 0,010 - 0,010 = 0 |
0,1 - xf 0,10 – 0,010 = 0,090 |
0,020 + xf 0,020 + 0,010 = 0,030 |
0,100 + xf 0,100 + 0,010 =
0,011 |
b) Calcul
des concentrations finales.
[Fe2+(aq)]f = 0 mol.L–1
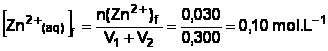

Q4
Pour voir un exercice similaire clique ici.
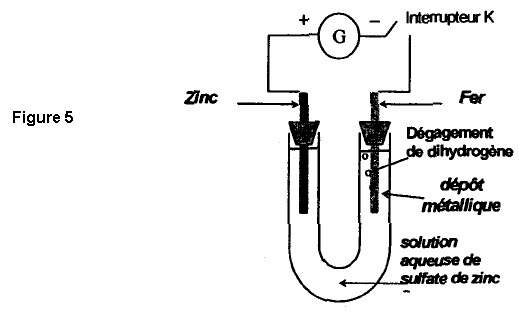
Les électrons se déplacent dans les fils et les électrodes.
Les ions dans l’électrolyte.
Les électrons se partent de la borne – de la pile et se dirigent vers la borne +.
Les anions ( SO42- , HO-) se déplacent
dans le sens des électrons, les cations ( Zn2+ , H3O+,
Fe2+) dans le sens inverse .
2 réactions de réductions se produisent sur l’électrode de
fer :
Le dégagement de
dihydrogène est dû à la réduction des ions hydrogène H+(aq).
½ équation de réduction : 2H+(aq)
+ 2 e– = H2 (g)
La formation du dépôt métallique correspond à la réduction
des ions Zn2+(aq)
½ équation de réduction : Zn2+(aq)
+ 2 e– = Zn(s)
L’électrode de fer est la cathode car il s’y produit une
réaction de réduction.
c) Intérêt du dépôt de zinc sur la plaque de fer : le
zinc protège le fer de l’oxydation. On utilise cette technique pour protéger
les tôles de fer qui recouvrent les
toits.
d) L’électrode de zinc est le siège d’une oxydation :
½ équation d’oxydation : Zn(s)
= Zn2+(aq) + 2 e–
Au cours de la réaction du métal zinc est consommé, la
masse de l’électrode diminue.
Q5
a)
Equation aux électrodes :
A la cathode, réduction des ions Zn2+(aq)
½ équation de réduction : Zn2+(aq)
+ 2 e– = Zncathode (s),
A l’anode, l’électrode de zinc est le siège d’une
oxydation :
½ équation d’oxydation : Znanode
(s) = Zn2+(aq)
+ 2 e–
Equation bilan de l’électrolyse :
Znanode, (s) + Zn2+ (aq) = Zn2+(aq) + Zncathode, (s)
b) Pour voir la correction vidéo clique ici. Quantité
d’électricité débité par la pile (Dt = 10
min = 600 s, I = 0,5 A) :
Q = I.Dt = 0,5´10´60 =
3,0 x 102 C
Quantité de matière d’électrons correspondant : Q = ne.NA.e
![]()
D'après la demi-équation d'oxydation à l’anode : nZn,disp
= ne/2
c) mzn,disp = nZn,disp ´ MZn =
1,55 x 10-3 x 65,4 = 0,101 g