ÉTUDE DE mÉdicaments à base
d'ASPIRINE (Nouvelle Calédonie Novembre 2007 4 points)
1.
Questions préliminaires
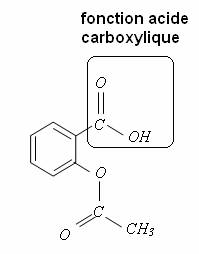
1.1.
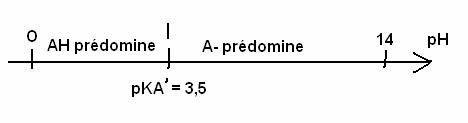
1.2. Diagramme de prédominance des espèces
chimiques du couple AH /A – .
pKA
= 3,5
1.3
pHestomac =
2 < pKA , AH prédomine dans l’estomac c’est sous cette forme que
l’organisme absorbe l’aspirine
pHintestiin = 8 > pKA , A-
prédomine dans l’intestin c’est sous cette forme qu’il sera assimilé par
l’organisme.
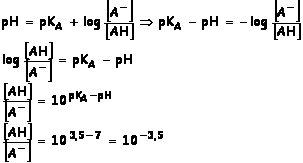
A pH
= 7 c’est la forme basique de l’aspirine qui prédomine [A-] >>
[AH].
2.
L'aspirine simple
2.1.
La forme AH
est liposoluble. La muqueuse de l'estomac (muqueuse gastrique) présente des
lipides au niveau de ses tissus AH peut se dissoudre dans les tissus de l’estomac.
2.2 A
solubiliser dans un grand verre d’eau de manière à ce que l’acide soit le plus
dilué possible pour ne pas bruler l’estomac.
2.3.
2.3.1.
10,0 mL de
solution de soude de concentration molaire cB = 1,0 mol.L–1 :
ni (HO – ) = CB.VB
= 1,0x10-2 = 1,0x10-2 mol
2.3.2.
cA = 5,0 ´ 10 –2 mol.L–1: ;VAE
= 8,4 mL
A
l’équivalence les réactifs ont été introduits dans les proportions
stœchiométriques :
cAVAE
= cB.VB = n
n = 5,0x10-2x8,4x10-3
= 4,2x10-4 mol
quantité
de matière n’ d'ions hydroxyde
en excès présente dans les 100,0 mL de
départ. :
n’ = 10.n = 10x 4,2x10-4=4,2x10-3
mol
2.3.3.
Dessiner un tableau d’avancement de la
réaction 1.
|
Relation stœchiométrique |
AH
+ 2 HO – = C7H5O2- + CH3CO2 – +
H2O |
|||||
|
État du système |
Avancement(mol) |
Quantité de matière en mol |
||||
|
État initial |
|
n(asp) |
ni(HO-)
|
0 |
0 |
excès |
|
Au cours de la transformation |
|
n(asp)-x |
ni(HO-)-2x |
x |
x |
excès |
|
État final attendu |
xmax |
n(asp)-xmax = 0 |
ni(HO-)-2xmax
= n’ ni(HO-)-2n(asp)
= n’ |
xmax |
xmax |
excès |
2.3.4.
D’après le tableau d’avancement :
La quantité d’hydroxyde ayant réagi est :
ni(HO-)-2.n(asp)
= n’
n(asp) = (ni(HO-)
– n’)/2
n(asp) = (10-2 – 4,2x10-3) /2
n(asp)
= 2,9x10-3 mol
2.3.5.
M(acide acétylsalicylique ) = 180 g.mol –1.
m(asp) = n(asp) .M
m(asp) = 2,9x10-3x180 = 0,52 g = 520 mg
Ecart relatif: ![]()
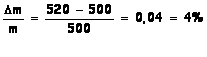
Le
résultat est similaire à l’indication du fabricant.
L'aspirine
pH8
3.1.
En
présence des sucs gastriques contenus dans l’estomac le comprimé ne sera pas
dissous puisqu’il ne réagit pas avec la solution d’acide chlorhydrique.
3.2.
L’enrobage
empêche le médicament d’être absorbé immédiatement d’ou le qualificatif aspirine
pH8 d'aspirine « retard ».
3.3.
En croquant l’enrobage, on détruit la protection
autour de l’aspirine, sa forme acide est libérée et provoque des brulures d’estomac.