Synthèse d'une odeur (D’après Bac Antilles 2001)
1)
acide éthanoïque : fonction encadrée
acide carboxylique
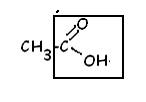
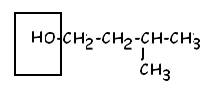
3-méthylbutan-1-ol :
fonction encadrée alcool primaire.
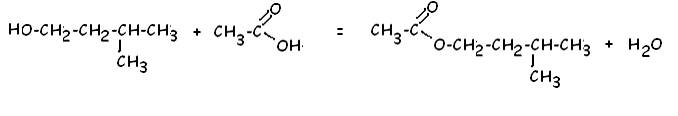
1)
Equation bilan de
la réaction
2)
Un excès d’un des
deux réactifs améliore le rendement.
3)
L'acide
sulfurique concentré sert de catalyseur, il accélère la réaction.
4)
Chauffer le
mélange réactionnel permet d’accélérer la réaction.
5)
Intérêt du
réfrigérant est de condenser les réactifs et les produits qui s’échappent et de
les faire refluer dans le ballon. Il ya moins de pertes de matière.
6)
Rendement de la
réaction.
Le réactif en défaut est
l’alcool (n1 = 100 mmol de 3-méthylbutan-1-ol )
A partir de n1 = 0,1 mol
d'alcool on peut théoriquement obtenir 0,1 mol d'ester
Masse molaire de l'ester :
M(C7 H14O2) = 7*12+14+2*16 = 130 g/mol
Quantité de matière ‘n’
expérimentale d’ester obtenue :
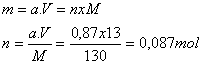
![]()
Le rendement est de 87%