Dosage du fer blanc dans l’étain (bac Polynésie 2003) énoncé
Q1

a)
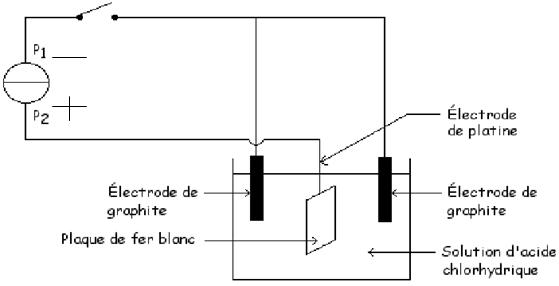
La plaque de fer blanc est le siège d’une oxydation. Or à l’anode il y a une
oxydation.
La plaque de fer blanc constitue l’anode pour cette électrolyse.
Des électrons partent de la plaque de fer blanc, vers la borne P2.
Le sens du courant i est l’ inverse de celui des électrons. Il se déplace de la
plaque P2 vers la plaque de fer.
P2 correspond à la borne positive de la pile (le courant
sort de la borne positive du générateur et va vers l’électrolyseur ).
Franchement vous me dites, mais j’ai pas un peu délirer sur la
taille du + et moins de la pile ? Envoyez moi vos remarques à thierry.collet@hotmail.fr
Q2
a) I2(aq)+ Sn2+(aq)=
2 I-(aq)+ Sn4+(aq)
½ réaction
d’oxydation (perte d’électrons)
Sn2+(aq)
= Sn4+(aq) + 2e-
½ réaction de
réduction (gain d’électrons)
I2(aq)
+ 2 e- = 2 I-(aq)
b) Quantité de
matière de diiode n introduite dans le bêcher au début de l'expérience.
n
= C.V = 1 x 10-2 x 10 x 10-3 = 10-4 mol
Q3
a)
Le dosage du diiode par la solution de thiosulfate de sodium est modélisée par
la réaction d'équation :
2 S2O32-(aq)+ I2(aq)
= S4O62-(aq)+ 2 I-(aq)
(réaction n°2)
Quantité
de matière n2 de diiode ayant réagi avec les ions thiosulfate. A
l’équivalence Le volume de la solution aqueuse de thiosulfate de sodium versée
est V' = 9,7 mL. 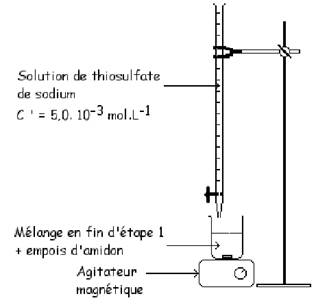 Les
réactifs sont introduits dans les proportions stœchiométriques :
Les
réactifs sont introduits dans les proportions stœchiométriques :
![]()
b)
En déduire la quantité de matière n(Sn2+) d'ions Sn2+(aq)présente
dans le bêcher après l'électrolyse.
c)
Déduire, à l'aide de la question Q1 c., la quantité de matière d'étain n(Sn)
sur la plaque de fer blanc puis m(Sn), la masse d'étain correspondante.
Rappel :
Sn(s) = Sn2+(aq) + 2 e-
puis,
lorsque tout l'étain a été attaqué,
Fe(s)
= Fe2+(aq) + 2 e-
On
arrête l'électrolyse dès l'apparition de la coloration rouge car à cet instant
tout l’étain à été consommé. Les premiers ion Fe2+ produits
réagissent avec l’orthophénanthroline pour donner un complexe de couleur rouge
c)
La réaction Sn(s) = Sn2+(aq) + 2 e- est totale :
n(Sn)i – xmax = 0 et n(Sn2+)formé
= xmax
n(Sn)i = n(Sn2+)formé