Dosage des ions Fe2+ par spectrophotométrie (bac 2002 Guadeloupe) énoncé
Q1
a)
L’équation suivante est une réaction d’oxydoréduction :
2 Fe3+(aq) + Zn(s) = 2 Fe2+(aq) + Zn2+(aq)
En
effet elle correspond a la somme de 2 demi-réactions au cours desquelles il y a
un transfert d’électrons.
Par
exemple, au cours de cette réaction, le réducteur métal zinc (Zn) perd 2
électrons pour donner son oxydant conjugué l’ion zinc II (Zn2+).
b)
½ réaction de réduction (gain d’électrons) :
x2 ( Fe3+(aq) + 1 e-
= Fe2+(aq) )
½
réaction d’oxydation (perte d’électron)
Zn(s) = Zn2+(aq)
+ 2 e-
Q2
a)
Données : masse molaire du sel de Mohr M = 392,1 g.mol-1 ;
masse du sel de Mohr m = 0,20 g
Quantité
de matière de sel de Mohr mise en solution :
![]()
b)
Données : n = 5,1 x 10-4 mol V = 500 mL = 0,5 L
Concentration
molaire :
![]()
Le
sel de Mohr se dissous suivant l’équation suivante :
FeSO4,(NH4)2SO4,6
H2O(s) = Fe2+aq + 2SO42-aq
+ 2NH4+aq + 6 H2O
En
considérant la dissolution totale une mole de sel de Mohr va fournir une mole
d’ion Fe2+ : n = n (Fe2+) par conséquent :
![]()
Q3
a)
Au cours d’une dilution on ne fait que
rajouter de l’eau : la quantité de matière d’ion
Fe2+ ne varie pas.
b)
Au cours de la dilution le nombre de mole d’ions Fe2+
prélevé dans la solution mère (C. vi) est égal au nombre de mole
d’ions Fe2+ présent dans la solution fille ( [Fe2+] . (V + Vo) ) :
(ne
pas oublier le volume Vo = 10 mL de solution d’orthophénantroline)
C.vi = [Fe2+]. (V + Vo)
![]()
![]()
c)
Dans ce type de question, n’expliquer qu’une fois le raisonnement.
Bêcher
1 : vi = 5 mL ; V =
50 mL ; Vo = 10 mL ; C = 1,0 x 10-3 mol.L-1
![]()
Remarque :
on peut laisser les volumes en mL (un rapport de même unité est sans unité)
On
obtient le tableau de résultat suivant :
|
bécher |
1 |
2 |
3 |
4 |
|
vi(mL) |
5,0 |
2,5 |
1,0 |
0,5 |
|
[Fe2+]
(mol.L-1) |
8,3x10-5 |
4,2x10-5 |
1,7x10-5 |
0.83x10-5 |
Q4
a)
Sur le graphe on constate que la relation A = f ([Fe2+] ) est
représentée par une droite passant par l’origine. Par conséquent l’absorbance A
est proportionnelle à la concentration en ions Fe2+ :
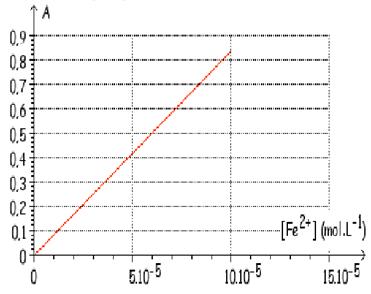 A = k.[Fe2+]
A = k.[Fe2+]
b)
Pour calculer le coefficient directeur de la droite il suffit de prendre 2
points
Mo et M1 et de déterminer leurs coordonnées :
M1
MO ( [Fe2+]o =
0 ; Ao = 0)
M1 (
[Fe2+]1 = 5,0 x 10-5 mol.L-1 ;
A1 = 0,42)
Le
coefficient directeur est égal à :
Mo
![]()
Q5
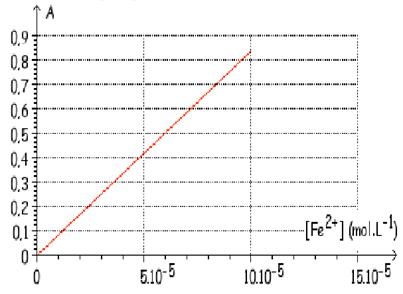 a) Pourquoi respecter les
volumes de 50 mL de Sx et 10 mL d’orthophénantroline ?
a) Pourquoi respecter les
volumes de 50 mL de Sx et 10 mL d’orthophénantroline ?
Pour
se trouver dans les mêmes conditions que celle permettant d’obtenir
la
courbe d’étalonnage ( on prélevait 50 mL de chaque solution auquel on ajoutait
10 mL de solution d’orthophénantroline).
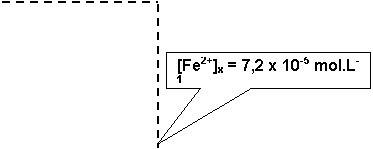 b) A l’aide de la courbe
d’étalonnage et de la valeur de l’absorbance
b) A l’aide de la courbe
d’étalonnage et de la valeur de l’absorbance
A
= 0,6, on détermine graphiquement la valeur de la concentration en ion
Fe2+ de
la solution mystérieuse Sx:
[Fe2+]x
= 7,2 x 10-5 mol.L-1
c)
Pour voir la correction vidéo clique ici.
Quantité
de matière d’ion Fe2+ dans V = 50 mL de solution :
n(Fe2+)
= [Fe2+].V = 7,2 x 10-5 x 50 x 10-3 = 3,6 x 10-6
mol
Par conséquent
pour les 200 mL de solution la quantité de matière d’ions Fe2+ est 4 fois plus
importante :
n ( Fe2+) = 4 x 3,6 x 10-6 = 1,44 x 10-5 mol
Dans
une mole d’oxyde de fer Fe2O3 il y a 2 moles d’ion Fe2+
par conséquent :
![]()
La
masse d’oxyde de fer présente dans l’échantillon est :
m(Fe2O3) = n(Fe2O3) . M(Fe2O3) =
7,22x10-6 x 160 = 1,15 x 10-3 g