Chapitre 6 :
SOLUTIONS
ET CONCENTRATION MOLAIRE
I- QU’EST-CE
QU’UNE SOLUTION ?
Définitions :
Lorsqu’on
dissout une espèce chimique, solide, liquide ou gazeuse (minoritaire) appelé soluté, dans un liquide (constituant
majoritaire) appelé solvant, on
obtient une solution. Si le solvant utilisé est de l’eau alors on obtient une solution aqueuse.
Une solution est homogène si elle a le même aspect partout. Une solution dans
laquelle tout le solide introduit n’est pas dissous est une solution saturée.
Une solution peut contenir des ions ou des
molécules.
Exemple : * L’eau salée contient des ions Na+
et Cl- dispersés parmi des molécules d’eau. Le soluté est le
chlorure de sodium, le solvant l’eau, on obtient une solution aqueuse de
chlorure de sodium.
* L’eau sucrée contient des molécules de
saccharose C12H22O11 dispersés parmi des molécules d’eau.
II- NOTION DE
CONCENTRATION MOLAIRE :
2.1.
Définition :
La concentration
molaire d’une espèce chimique en solution est égale à la quantité de matière de
cette espèce présente dans
La
concentration molaire d’une espèce chimique A se note [A] ou CA.
Elle s’exprime en mol.L-1
Si
l’on note nA la quantité de matière de l’espèce chimique A et V, le
volume de solution, la concentration molaire en soluté de la solution
est :
CA = nA / V
Avec
CA en mol.L-1 ; nA
en mol et V en L
2.2. Calcul d’une
concentration :
On
prépare une solution de glucose C6H12O6 en
dissolvant une masse m =
On
donne M(H) =
Correction :
·
On détermine la quantité de matière de glucose contenue
dans l’échantillon de
n(C6H12O6) = m(C6H12O6)/M(C6H12O6)
A.N. n(I2)=5,4/180
= 3,0.10-2 mol
·
On calcul la concentration molaire de la solution en
glucose :
[C6H12O6] = n(C6H12O6)
/ V
A.N. [C6H12O6]
= 3,0.10-2 /0,050 = 6,0.10-1 mol.L-1
2.3. concentration massique ou
titre massique ‘t’
La
concentration massique ou titre massique d’une espèce chimique en solution est égale
à la masse de cette espèce présente dans
La
concentration molaire d’une espèce chimique A se note tA . Elle
s’exprime en g.L-1.
Si
l’on note mA la masse de l’espèce chimique A et V le volume de
solution, la concentration massique en soluté de la solution est :
tA = mA
/ V
Avec tA en g.L-1 ; nA
en mol et V en L
III- PREPARATION DE SOLUTIONS :
3.1. Verrerie utilisée au
laboratoire
3.2. Dissolution d’un
solide
Pour
préparer un volume V de solution de concentration C par dissolution d’un
composé solide, il faut :
·
Calculer la masse de solide à prélever.
·
Peser à l’aide d’une balance électronique la masse de solide dans une
coupelle.
·
Introduire le solide dans une fiole jaugée de volume V et rincer la
coupelle à l’eau distillée.
·
Ajouter de l’eau distillée aux ¾. Boucher et agiter pour dissoudre tout
le solide.
·
Compléter d’eau distillée jusqu’au trait de jauge. Boucher, agiter pour
homogénéiser.
3.3. Dilution d’une
solution
Pour
préparer un volume V1 de solution de concentration C1 par
dilution d’une solution initiale de concentration C0, il faut :
·
Calculer le volume V0 de solution initiale à prélever.
·
Prélever ce volume à l’aide d’une pipette jaugée munie d’une
propipette.
·
Introduire ce volume dans une fiole jaugée de volume V1.
·
Compléter d’eau distillée jusqu’au trait de jauge. Boucher, agiter pour
homogénéiser.
Diluer une solution c’est, en
ajoutant du solvant, constituer une nouvelle solution moins concentrée que la
solution initiale. Lors d’une dilution, la concentration molaire du soluté
diminue, mais sa quantité de matière ne change pas.
Exemple de calcul de solution mère à prélever : La solution mère à une concentration Co = 1,0 mol.L-1.
On veut préparer une solution fille de chlorure de sodium (Na+,Cl-)
de concentration C1 = 1,0x10-1 mol.L-1 et de
volume V1 = 100 mL.
Au cours de la dilution la quantité de
matière n0 de soluté prélevée dans la solution mère est égale à la
quantité de matière n1 de soluté se trouvant dans la solution
fille :
n1 = no
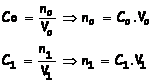
Co.Vo = C1.V1
Le volume de solution mère à prélever
est:
![]()