Chapitre 7 :
BILAN DE MATIERE
I.
TRANSFORMATIONS
CHIMIQUES :
Etude d’un
exemple :
·
Espèces chimiques en présence avant la transformation :
** la solution de nitrate d’argent contient des
ions argent Ag+ et des ions nitrate NO3-
** le métal cuivre contient des atomes Cu
·
expérience et observations :
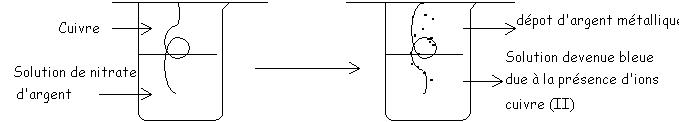
Conclusion :
On dira qu’il s’est produit une transformation
chimique.
Définitions
:
Un système chimique est un ensemble d’espèces
chimiques susceptibles de réagir entre elles et sur lesquelles porte une étude
particulière.
Son état sera décrit en précisant :
·
la nature et la quantité de matière des
espèces chimiques présentes ;
·
l’état physique : solide (s), liquide
(l), gazeux (g), en solution aqueuse (AQ)
·
la température T et la pression p du
système
Un système chimique peut évoluer et subir une
transformation chimique qui modifie son état.
Etat
initial, état final :
- On
appelle état initial du système chimique, l’état de ce système avant
la transformation.
- On
appelle état final du système chimique, l’état de ce système après
la transformation.
- Les
espèces introduites à l’état
initial sont appelées « réactifs »,
les espèces obtenues après la
transformation, à l’état final sont appelés « produits »
- La
transformation chimique est le passage de son état initial à son état
final.
Etat final P = 1
bar ; q = 20° Ag (s) : nAg Ions Cu2+ Ions NO3- Molécules d’eau H2O Etat
initial P = 1 bar ;
q =
20° Cu (s) Ions Ag+ Ions NO3- Molécules d’eau H2O
transformation
![]()
chimique
II.
MODELISATION DE
La
réaction chimique :
Elle modélise la transformation chimique subie par
un système. Elle ne fait intervenir que les réactifs et les produits de la
transformation et pas les espèces chimiques spectatrices.
L’équation
chimique d’une réaction :
L’équation chimique décrit l’évolution d’un
système dans lequel se déroule une réaction chimique. Les réactifs et les
produits y sont représentés par leur formule : les réactifs à gauche de la
flèche, les produits à droite. :
![]() Réactifs
Produits
Réactifs
Produits
Comme, nous
l’avons vu précédemment, au cours d’une transformation chimique, il y a
conservation des éléments et de la charge électrique : il faudra donc
ajuster l’équation avec des nombres placés devant les symboles, appelés nombres
stoechiométriques :
![]() 2 Ag+ (aq) + Cu(s) 2 Ag (s) + Cu 2+
(aq)
2 Ag+ (aq) + Cu(s) 2 Ag (s) + Cu 2+
(aq)
Remarque : les espèces chimiques présentes dans le système, qui ne réagissent pas, n’interviennent pas dans l’écriture de l’équation. (NO3-)
Signification
des nombres stoechiométriques :
Les
nombres stoechiométriques renseignent sur les proportions, en quantité de
matière, dans lesquelles les réactifs réagissent et les produits se forment.
Exemple : Cu
+ 2
Ag+ ® 2 Ag + Cu2+
Cette équation indique que si n mol de Cu est consommé alors 2n mol d’ions Ag+ sera aussi consommé et il se formera 2n mol d’argent Ag et n mol d’ions cuivre Cu2+.
Lorsque
les réactifs sont mélangés dans les proportions indiquées par l’équation
chimique, on dit que le mélange est stoechiométrique. Lorsque les
réactifs ne sont pas dans les proportions stoechiométriques, la transformation
a lieu tout de même et s’arrête lorsqu’un réactif est entièrement
consommé : c’est le réactif limitant.
III.
AVANCEMENT ET BILAN DE
MATIERE :
Notion
d’avancement :
Afin de décrire l’évolution d’un système chimique
subissant une transformation chimique, on utilise un outil : l’avancement de la transformation.
L’avancement est un nombre, noté
x qui s’exprime en mole et qui permet de
déterminer les quantités de réactifs transformés et les quantités de produits
formés.
L’avancement varie au cours de l’évolution du
système chimique : il vaut zéro pour l’état initial et atteint sa valeur
maximale xmax pour l’état final.
Conservation de la matière et
avancement :
La conservation de la matière permet d’exprimer les quantités de
matière de tous les réactifs et de tous les produits de la transformation en
fonction de l’avancement au cours de la transformation.
Exemple : Cu
+ 2
Ag+ ® 2 Ag + Cu2+
Par
définition, lorsque l’avancement est égal à x en mol alors :
- Il est apparu 2x mol
d’argent et x mol d’ions cuivre
- Il a disparu x mol
de cuivre et 2x mol d’ions argent
Tableau d’avancement d’une réaction
chimique :
Il permet de visualiser l’évolution du système chimique.
1ère ligne du tableau : on écrit l’équation chimique ajustée
2ème ligne du tableau : on
écrira ‘’état du système’’, ‘’avancement
‘’, et ’’quantités de matière ‘’.
3ème ligne du tableau : il décrit
l’état initial – l’avancement vaut 0
4ème ligne du tableau : il donne
l’état du système au cours de la transformation pour un
avancement x donné.
5ème ligne du tableau : il décrit
l’état final – l’avancement vaut xmax
exemple :
Equation
chimique
|
|
CH4
+ 2 O2 ® CO2 + 2 H2O |
|||
Etat du système
|
Avancement |
Quantités
de matière ( en mol ) |
|||
|
Etat
initial |
x = 0 |
2 |
4 |
0 |
0 |
|
Au cours de la transformation |
x |
2 - x |
4 - 2x |
x |
2x |
|
Etat
final |
x = xmax |
2 - xmax
= 0 |
4 - 2xmax = 0 |
xmax
= 2 |
2xmax = 4 |
Avancement maximal d’une réaction
chimique :
L’avancement maximal xmax permet de connaître l’état final d’un
système. Il correspond à la disparition du réactif limitant.
C’est la plus petite valeur de x pour laquelle la
quantité de l’un des réactifs est nulle.
Exemple :
réaction entre les ions cuivre et les ions hydroxyde :
Toutes les quantités de matière du tableau sont
exprimées en mole.
Equation chimique : Cu2+
+ 2 OH- è Cu(OH)2
Etat du système
|
Avancement |
Quantités
de matière ( en mol ) |
||
|
Etat
initial |
x = 0 |
no(Cu2+)=3.10-3 |
no(OH-)=9.10-4 |
0 |
|
Au cours de la transformation |
x |
no (Cu2+)-x=3.10-3-x |
no( |
x |
|
Etat
final |
x = xmax |
no(Cu2+)-xmax
= 25,5x10-4 |
no( |
xmax = 4,5x10-4 |
Etat final , calcul de xmax :
Soit les ions Cu2+ sont le réactif limitant alors : no(Cu2+) – xmax
= 3.10-3- xmax = 0
soit xmax = 3.10-3 mol
Soit les ions HO- sont le réactif
limitant alors : no(OH-)
– 2xmax
= 9.10-4- 2xmax = 0 soit xmax = 4,5.10-4mol
Le réactif limitant est ici les ions HO- et xmax = 4,5.10-4 mol