Chapitre 9 :
LE MODELE DU GAZ PARFAIT
I.
1.1.
Enoncé :
A
température constante, pour une quantité donnée de gaz, le produit de la
pression P par le volume V occupé par le gaz est constant : P.V =
constante
II.
Modèle du gaz parfait :
Le gaz parfait est un
modèle simplifié des gaz. Dans ce modèle on suppose que toutes les interactions
entre les molécules sont négligeables (à l’exception des chocs).
Equation d’état du gaz parfait :
On montre que les quatre
variables d’état sont liées par une relation appelée :
Equation d’état des gaz parfaits
P.V =
n.R.T
|
P en pascal (Pa) V en mètre cube (m3) T en Kelvin (K) n en mole (mol) R est la constante des
gaz parfaits (R=8,32 SI) |
III.
GAZ
REELS :
Comportement de l’air et des autres gaz :
Jusqu’à une pression de
quelques bars, les gaz courants (He, Hé, O2, CO2…)
peuvent être considérés comme parfaits ainsi que l’air.
Ce comportement des gaz
aux faibles pressions peut s’expliquer en considérant qu’à température
constante, plus le volume occupé par une quantité de matière de gaz donnée
augmente, plus la pression de ce gaz diminue.
Donc, les distances
entre les molécules de gaz deviennent très grandes et les interactions entre
les molécules négligeables.
Volume molaire d’un gaz :
Le volume molaire d’un gaz, noté Vm,
est le volume occupé par une mole de ce gaz.
Ce volume dépend de la température, de la pression
et est indépendant de la nature du gaz.
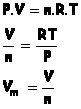
Dans les conditions
normales de température et de pression : T = 273K et P = 1,013.105
Pa
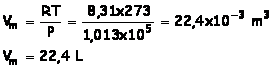
La plupart des gaz, sous
faible pression, se comportent en gaz parfait : leur volume molaire est
égale à celui du gaz parfait. Ce résultat est connu sous le nom de loi
d’Avogadro-Ampère.