Chapitre
2 : suivi temporel d’une réaction chimique
Étude
cinétique par conductimétrie
Dans cet exercice, on
s’intéresse à la réaction
d’oxydoréduction entre les ions peroxodisulfate
S2O82- et les ions iodure I- en solution aqueuse.
Donnée. Couples
oxydant/réducteur:
S2O82-
/ SO42- et I2/I-.
Dans un bêcher, on
introduit un volume V1 =
40 mL d’une solution aqueuse de peroxodisulfate de potassium (2K+ + S2O82- ) de
concentration
C1 = 1,0 X 10-1 mol. L-1. À l’instant t = 0 s, on ajoute un
volume V2 = 60 mL d’une solution
aqueuse d’iodure de potassium (K+
+ I-) de concentration C2 = 1,5 X 10-1
mol. L-1.
L’expérience est conduite à la température t1
de
Un conductimètre,
relié à un système d’acquisition de données,
permet de suivre l’évolution de la conductance de la solution au
cours du temps. La courbe obtenue est reproduite ci-après.
Q1
a) Écrire les
demi-équations électroniques pour chacun des deux couples qui
interviennent dans cette réaction. On donnera en justifiant le nom de
chacune de ces réactions.
b) En déduire
l’équation de la réaction entre les ions peroxodisulfate et les ions iodure.
c) Remplir le tableau
d’avancement suivant. En déduire la composition du mélange
réactionnel en fin de réaction si la réaction est totale
(x(finale) = x(max) ). Quel est le réactif en défaut ?
Les quantités de
matière sont exprimées en mole
|
Relation
stœchiométrique |
|
||||
|
Avancement |
Quantité de
matière en mol |
||||
|
État
initial |
|
|
|
||
|
Au
cours de la transformation |
|
|
|
|
|
|
État
final attendu |
xmax |
|
|
|
|
d) En notant x
l’avancement de la réaction à l’instant t, donner les
expressions des concentrations des divers ions présents dans le
mélange( ne pas oublier k+ !) en fonction de x, du
volume V de la solution, des volumes
V1 et V2 et des concentrations C1 et C2
.
Q2
On négligera les
ions H3O+ et HO- très minoritaires devant les autres ions.
L’expression de la
conductance G d’une telle solution est :
G= k ( l1[ S2O82-
] + l2[ I- ] + l3[ SO42- ]
+ l4[ K+ ] )
Montrer que la relation
entre la conductance G et l’avancement x de la réaction est de la
forme G= (1/V).(A + Bx)
où V est le volume
total de la solution, constant pendant toute la durée de
l’expérience.
Q3
a) Pour la suite de
l’étude, on donne les valeurs des constantes (dans les conditions
de l’expérience) :
A = 1,9 mS.L et
B = 42 mS.L.mol-1
Définir la
vitesse volumique de la réaction en fonction de l’avancement x.
b)
En
déduire son expression en fonction de G.
c) Déterminer la
valeur vo de la vitesse
volumique à la date t = 0 s (instant du début de
réaction).
Q4
a) Définir le
temps de demi réaction.
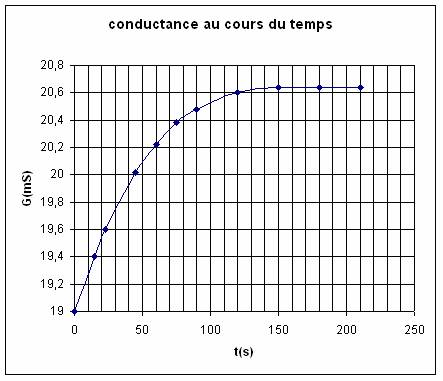
b) Donner l’expression littérale de la conductance à t = 0 (Go) et à la fin de la réaction (Gmax). Vérifier les valeurs de Go et Gmax à l’aide du graphique.
c) Donner l’expression de la conductance au temps de ½ réaction G1/2 en fonction de Go et Gmax
d) Calculer G1/2 et en déduire graphiquement le temps de demi-réaction.
e) On renouvelle
l’expérience à la température t2 =
Annexe
