Chapitre 9 : électrolyse une transformation forcée
A propos du zinc (Bac USA 2005)
Certaines transformations
chimiques peuvent mettre en jeu la réaction modélisée par l’équation (1) :
Fe2+(aq) +
Zn(s) = Zn2+(aq) +
Fe(s) équation (1)
dont la constante d’équilibre associée est : K = 1,40´1011.
Pour étudier expérimentalement des transformations mettant en jeu les
espèces chimiques Fe2+(aq), Zn(s), Zn2+(aq),
Fe(s) on dispose :
-
d’une solution
aqueuse de sulfate de fer S1 contenant des ions Fe2+(aq)
de concentration 1,00 ´ 10-1 mol.L-1
-
d’une solution
aqueuse de sulfate de zinc S2 contenant des ions Zn2+(aq)
de concentration 1,00 ´ 10-1 mol.L-1
Les données nécessaires à l’exploitation des expériences 1
et 2 sont rappelées ci-dessous :
-
les
expériences sont réalisées à une température de 25°C ;
-
on se limite
aux couples oxydant/réducteur suivants : (Fe2+(aq) /
Fe(s)), (Zn2+(aq) / Zn(s)) ;
et (H+(aq) / H2
(g) );
-
masses
molaires : M(Fe) = 55,6 g.mol-1 et M(Zn) = 65,4 g.mol-1 ;
-
nombre
d’Avogadro : NA = 6,02´1023 mol-1 ;
-
charge
élémentaire : e = 1,60´10-19 C.
A – EXPERIENCE 1 – TRANSFORMATION SPONTANEE
A l’instant t = 0, on mélange dans un grand bécher 100 mL de la solution
S1, 200 mL de la solution S2, 5,56 g de fer et 6,54 g de
zinc, puis on agite.
La transformation chimique de ce système peut être modélisée par
l’équation (1).
Q1
a) Écrire les
demi-équations électroniques qui conduisent à cette équation.
b) Déterminer les
quantités de matière d’ions fer (II) et d’ions zinc (II) introduites
initialement.
Q2
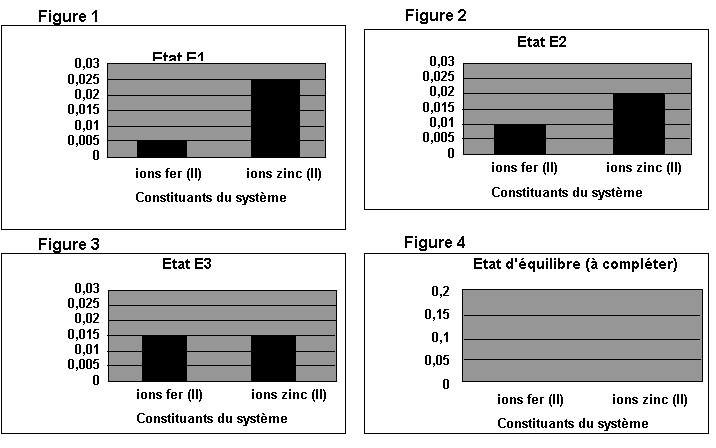
a) Le système chimique
ainsi créé évolue spontanément. Une analyse du système permet d’obtenir des
histogrammes qui donnent les concentrations en ions fer (II) et en ions zinc
(II) pour différents états du système. Les trois histogrammes représentés sur
les figures 1 à 3 (annexe à rendre avec la copie) correspondent chacun à un état du système
lors de son évolution. Calculer le quotient de réaction associé à l’équation
(1) à l’état initial. Quel histogramme correspond à cet état ? Justifier.
b) Énoncer le
critère d’évolution spontanée d’un système chimique. Prévoir dans quel sens
évolue spontanément le système.
c) Calculer les
quotients de réaction Qr, 1 et Qr, 3 correspondant aux
états E1 et E3 (figures 1 et 3, annexe).
d) Les deux états E1
et E3 peuvent-ils correspondre à des états intermédiaires du système
entre l’état initial et l’état final ? Justifier.
Q3
L’avancement de la
transformation à l’état final est égal à 1,00´10-2 mol.
a) Compléter le
tableau descriptif de l’évolution du système (voir annexe) et déterminer les quantités de matière à
l’état final.
b) Compléter
l’histogramme donnant les concentrations en ions fer (II) et en ions zinc (II)
dans l’état final (figure 4 de l’annexe)
B – EXPERIENCE
2 – L’ELECTROLYSE
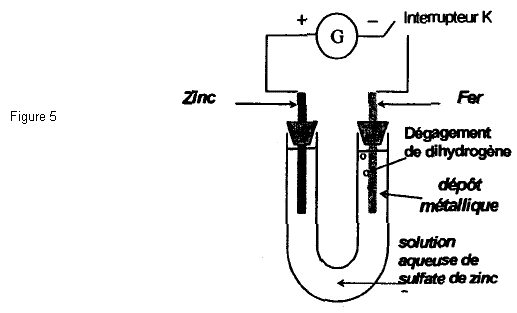
On réalise le montage représenté
figure 5, en annexe. Le générateur de tension continue permet de faire circuler
un courant électrique d’intensité I.
Q4
a) L’interrupteur
est fermé. On observe alors sur l’électrode de fer la formation d’un dépôt
métallique et un dégagement de dihydrogène. Représenter le sens de circulation
des porteurs de charges. On précisera leurs noms, dans la solution et dans les
fils de connexion.
b) En vous aidant
des couples donnés et des observations, écrire les demi-équations se produisant
à l’électrode de fer. Cette électrode est-elle l’anode ou la cathode ?
Justifier.
c) Quel est
l’intérêt pratique de ce dépôt métallique sur l’électrode de fer ?
d) Comment évolue
la masse de l’électrode de zinc ? Justifier votre réponse en écrivant la demi-équation
qui se produit à l’électrode de zinc.
Q5
a) On suppose
maintenant que seul le couple (Zn2+(aq) / Zn(s))
intervient au cours de l’électrolyse. Le générateur délivre une intensité du
courant I = 0,5 A pendant Dt = 10 min. Montrer que l’équation correspondant au bilan de
l’électrolyse peut s’écrire :
Znanode, (s) + Zn2+ (aq) +
= Zn2+(aq) + Zncathode, (s)
Cette électrolyse
est dite "à anode soluble”.
b) Calculer la
quantité d’électricité Q échangée pendant 10 min. En déduire la quantité de matière
d’électrons échangée ne. Quelle relation existe-t-il entre la
quantité de matière de zinc ayant disparu nZn, disp et la quantité
de matière ne d’électrons qui a circulé ?
d) Calculer la
variation de masse de l’électrode de zinc.
EXERCICE I: ANNEXE à rendre avec la copie
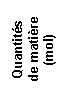
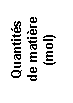
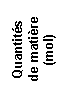
|
|
Avancement (mol) |
Équation de la
réaction |
|||
|
|
|||||
|
Etat Initial |
x = 0 |
|
|
|
|
|
Etat final |
x = xf
|
|
|
|
|