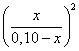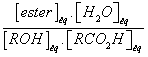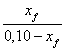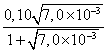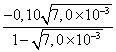Amérique du Sud 2003
 HÉMISYNTHÈSE
DE L'ASPIRINE AU LABORATOIRE (6,5 points)
HÉMISYNTHÈSE
DE L'ASPIRINE AU LABORATOIRE (6,5 points)
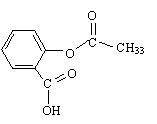
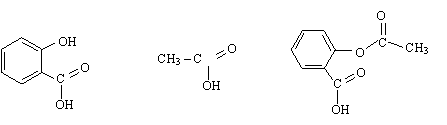
L'aspirine ou acide
acétylsalicylique a pour formule :
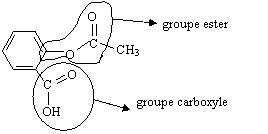
1. Recopier la formule puis entourer et nommer les deux
groupes fonctionnels (ou caractéristiques).
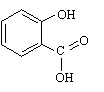
éthanoïque sur le groupe hydroxyle –OH de l'acide
salicylique de formule :
2.1. Comment appelle-t-on cette réaction ?
2.2. Écrire
l'équation de la réaction modélisant cette transformation en utilisant les formules
semi-développées.
2.3. Quelles sont ses principales
caractéristiques ?
3. Étude théorique de la
réaction entre l'acide acétique et l'acide salicylique.
On
considère la transformation effectuée à partir d'un mélange initial de 0,10 mol
d'acide acétique et 0,10 mol d'acide salicylique.
3.1. Compléter le tableau
descriptif de l'évolution du système chimique (ou tableau d'avancement) donné
en annexe à rendre avec la copie. On notera l'acide
salicylique ROH et l'acide acétique RCO2H.
3.2.1. Exprimer le quotient de
réaction Qr en fonction de l'avancement x
de la réaction.
3.2.2. Calculer sa valeur Qr,i dans l'état initial.
3.2.3. Sachant
que pour cette réaction la constante d'équilibre K = 7,0 ´ 10 –3, préciser
le sens d'évolution
de la réaction.
3.3.1. En appelant xf
l'avancement final correspondant à l'état d'équilibre du système, montrer que
la constante
d'équilibre associée à l'équation de la réaction se met sous la forme K = 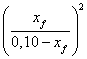 .
.
3.3.2. Démontrer que xf
= 7,7x10-3 mol.
3.3.3. Définir le taux d'avancement final de la transformation.
3.3.4. Montrer qu'il est inférieur à 8%.
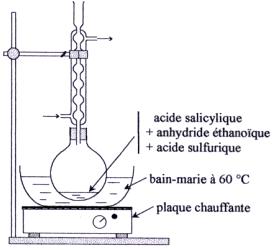
4. Une autre méthode de préparation.
Le taux d'avancement étant très
faible, on préfère préparer l'aspirine en faisant réagir l'acide
salicylique sur de l'anhydride éthanoïque.
Dans un ballon bien sec, on introduit avec précaution
:
-
- 12 mL d'anhydride éthanoïque mesurés à l'éprouvette graduée ;
- quelques gouttes d'acide sulfurique
concentré.
On
réalise le montage représenté ci-contre puis on chauffe
le mélange réactionnel au bain-marie à
Questions
concernant le protocole opératoire :
4.1.1. Comment
nomme-t-on ce type de montage ?
4.1.2. Quel est
le rôle du réfrigérant à boules ?
4.1.3. Pourquoi
chauffe-t-on le mélange réactionnel ?
4.1.4. Quel
est le rôle de l'acide sulfurique ?
4.1.5. Pourquoi
faut-il utiliser un ballon bien sec ?
4.1.6. Quelles précautions faut-il
prendre pour introduire l'anhydride éthanoïque et l'acide sulfurique
concentré dans le ballon ?
4.2.
Après 20 minutes de chauffage, on sort le ballon du bain-marie sans couper la
circulation d'eau puis on introduit par le haut du réfrigérant 10 mL d'eau distillée destinés à hydrolyser l'excès
d'anhydride acétique puis, quand l'ébullition cesse, 50 mL d'eau distillée glacée. Les cristaux d'aspirine
précipitent dans le ballon.
Après cristallisation
complète, on filtre sur büchner, on rince les
cristaux puis on les place à l'étuve à
80 °C pour les faire sécher. La masse
expérimentale d'aspirine obtenue est : mexp
=
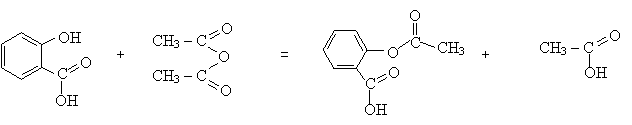 L'équation
de la réaction modélisant cette transformation est indiquée ci-dessous :
L'équation
de la réaction modélisant cette transformation est indiquée ci-dessous :
4.2.1. Montrer que l'anhydride acétique a
été introduit en excès (on pourra s'aider d'un tableau
d'avancement).
4.2.2. Calculer
la masse théorique mth d'aspirine que l'on peut obtenir en
considérant cette transformation
comme totale.
4.2.3. Définir
et calculer le rendement de cette transformation.
Données :
Masses
molaires : - de l'anhydride acétique : Manh. =
- de l'aspirine : Masp. =
- de l'acide salicylique : Mac.
= 138g.mol–1
Masse
volumique de l'anhydride éthanoïque : r =
FEUILLE
ANNEXE RELATIVE A L'EXERCICE III
HÉMISYNTHÈSE DE L'ASPIRINE AU
LABORATOIRE……
À RENDRE AVEC LA COPIE
Hémisynthèse de l'aspirine au laboratoire
3.1. Tableau d'avancement
Équation |
|
|||
|
Quantité
de matière dans l'état initial (en mol) |
|
|
|
|
|
Quantité
de matière en cours de transformation (en mol) |
|
|
|
|
|
Quantité
de matière théorique dans l'état final (en mol) |
|
|
|
|
|
Quantité
de matière dans l'état final (en mol) |
|
|
|
|
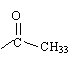
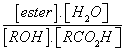
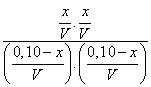 =
=