Chapitre
3 : vitesse de réaction chimique
Du chlore dans
l’eau de Javel (National 09/2004)
L’eau de Javel, produit courant et bon
marché, est une solution aqueuse contenant entre autres des ions
hypochlorite ClO–(aq) et des ions chlorure Cl–(aq).
Outre ses propriétés désinfectantes (c’est un
bactéricide puissant), l’eau de javel est utilisée pour son
pouvoir «blanchissant», lié à l’action oxydante
de l’ion hypochlorite sur de nombreux colorants.
L’eau de Javel se décompose lentement
selon une transformation totale modélisée par la réaction
d’équation :
2ClO–(aq) =
2 Cl–(aq)
+ O2 (g) réaction
(1)
On
se propose d’étudier la décomposition d’une eau de
Javel. Pour suivre l’évolution de cette transformation, on dilue
une solution commerciale S0 afin d’obtenir un volume V = 250
mL d’une solution S1 d’eau de Javel dix fois moins
concentrée que S0. On verse V1 = 20,0 mL de la
solution S1 dans un ballon. À l’instant de date t0
= 0 s où l’on déclenche le chronomètre, on ajoute,
sans variation de volume, une pointe de spatule de chlorure de cobalt dans la
solution et on bouche le ballon. L’ion cobalt Co2+(aq) est un
catalyseur de la réaction (1).Pour suivre l’évolution de la
transformation qui se déroule, on mesure, avec un dispositif
adapté, la pression p du gaz dans le ballon. On néglige la
quantité de dioxygène dissoute dans l’eau par rapport
à la quantité de dioxygène produite. La température
T est maintenue constante et le volume V0 occupé par le gaz
dans le ballon est constant : T = 296 K et V0 = 275 mL
|
t
(min) |
0 |
1,0 |
2,0 |
3,0 |
4,0 |
5,0 |
8,0 |
11,0 |
13,0 |
… |
145 |
427 |
1308 |
1757 |
1896 |
|
p(t)
(102 Pa) |
1020 |
1038 |
1038 |
1055 |
1063 |
1068 |
1078 |
1084 |
1086 |
… |
1103 |
1108 |
1111 |
1112 |
1112 |
La verrerie mise à disposition est en partie la suivante :
- fioles jaugées de 50 mL, 100
mL, 200 mL, 250 mL, 500 mL ;
- pipettes jaugées de 5 mL, 10
mL, 20 mL, 25 mL ;
- pipettes graduées de 5 mL, 10
mL, 20 mL, 25 mL ;
- éprouvettes graduées de
10 mL, 20 mL, 250 mL, 500 mL.
1) Quels
matériels, pris dans la verrerie mise à disposition, doit-on
utiliser pour préparer S1 ? Détailler les explications
de la préparation en faisant notamment un schéma. On notera
V’ le volume à prélever de la solution mère.
2) On note :
- n1 la
quantité initiale d’ions hypochlorite dans le volume V1 de solution dans le
ballon ;
- n2 la quantité
initiale d’ions chlorure dans ce même volume de solution ;
- n3 la quantité
initiale de dioxygène présent dans le ballon.
Compléter
la dernière ligne du tableau d’évolution du système
chimique, de l’annexe à rendre avec la copie (aucune
application numérique n’est demandée).
![]()
3) En supposant que le dioxygène O2(g) est un gaz
parfait, montrer que l’expression de l’avancement x(t) de la
réaction à l’instant de date t en fonction de p(t), p(t0
= 0), T et Vo est :
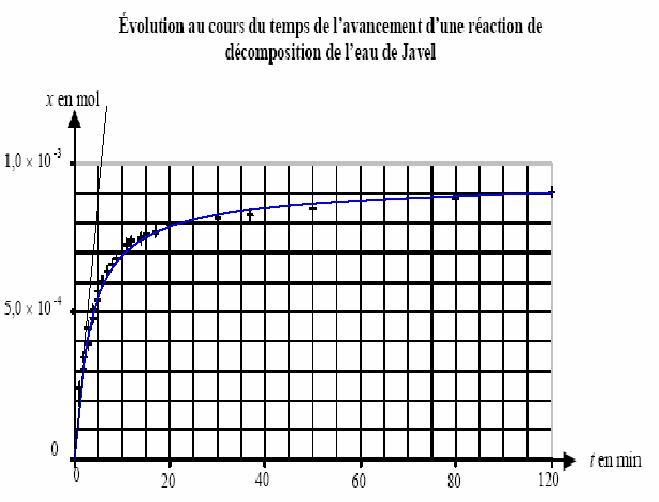
4) À partir des valeurs calculées de l’avancement x,
on trace la courbe de l’annexe (à rendre avec la copie)
Elle représente l’évolution, au cours du temps, de
l’avancement x de la réaction qui se déroule dans le
ballon. Définir à l’instant de date t, la vitesse
volumique v(t) de la réaction qui a lieu dans le ballon. Donner son
unité légale. Le volume de solution est V1 = 20 mL.
5) Comment évolue v(t)
au cours du temps ? Justifier la réponse, sans calcul, en utilisant le
graphique.
6) Citer
le facteur cinétique responsable de l’évolution de la
vitesse v(t) de la réaction au cours du temps.
7) Détailler la méthode
graphique permettant de déterminer la vitesse volumique de la
réaction à l’instant t = 0.
8) Déterminer la vitesse volumique
à l’instant t= 0 ,vo et à l’instant t =
120 min v120 . On choisira l’unité la plus simple pour
la vitesse.
9) Définir le temps de demi-réaction.
10) La valeur de l’avancement final
déterminée expérimentalement est xf = 9,0 ´ 10 – 4 mol.
En utilisant
cette valeur, déterminer graphiquement une valeur approchée du
temps de
demi-réaction. On fera apparaître clairement, sur la courbe de l’annexe (à rendre avec la
copie), la méthode utilisée.
ANNEXE
Tableau d'évolution
|
Équation de la
réaction |
2 ClO–
(aq) = 2 Cl–
(aq)
+
O2 (g) |
|||
|
État du
système |
Avancement (mol) |
|
|
|
|
État initial |
0 |
n1 |
n2 |
n3 |
|
Au cours de la
transformation |
x |
|
|
|