Chapitre 5 : constante d'acidité d'un
couple acide base
Acide base QCM (Bac 2001)
L'exercice est un questionnaire à choix multiples. A chaque question peuvent correspondre aucune, une
ou plusieurs propositions exactes. Pour chacune des questions,
chaque proposition doit être étudiée;. Aucune justification n ‘est demandée.
Il s'agit de monoacides de formule générale AH. Le logarithme décimal est noté
log.
Q1
Une solution aqueuse d'un monoacide a pour
concentration
c = 10-2mol.L-1 ;V =100 mL
a) si la concentration en ion oxonium finale [H3O+]f
=10-2 mol.L-1,
alors la réaction est totale.
b) si le taux d'avancement finale tf=1 alors l'avancement finale xf
=10-3 mol.
c) si la constante d'acidité de l'acide est Ka=10-3
et que le pH est 4 alors la concentration en base [A-] est 10 fois supérieure
à la concentration en acide conjugué [AH];
d)si tf=0,5
alors le nombre de mole d'ion H3O+ final est n(H3O+)f
= 0,25 mol;
Q 2
Parmi les couples acide/base ci-dessous, quel est ou
quels sont, celui ou ceux correctement écrit(s) ?
a) H20 / H3O+ ;
b) H20/HO- ;
c) H3O+ / HO- ;
d) HO- / H3Q+
Q3
La relation qui relie le pH d’une solution d’acide
faible HA au pka du couple
HA/A- peut toujours s'écrire :
a) pka = pH + log([A-]/[AH])
b) pH = pka - ( [AH]/[A-] )
c) pka = pH + log ([A-].[H3O+]/[HA])
d) pH = pka + log( [A-]/[H3Q+] )
Q4
Soient deux acides 1 et 2 tel que le taux
d'avancement final de leur réaction avec l'eau vérifie la relation suivante:
tf(1) > tf(2).
a) l'acide 1 possède le pH le moins élevé;
b) l'acide 2 possède le pH le plus petit;
c) Quel est l'âge de monique?
d)la constante d'acidité de l'acide 1 est :
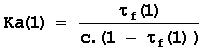
Q5
Soit une solution d’acide HA dont le pka du couple
associé vaut 4,2:
a) l’espèce A- prédomine pour pH = 6,2;
b) l’espèce
HA prédomine pour pH = 5,5 ;
c) les espèces A- et HA sont en quantité
égale à pH = 4,2 ;
d)aucune des espèces A- et HA ne
prédomine à pH = 7,0;
Q6
Une base est une espèce chimique capable:
a)d’accepter un proton;
b) de céder un électron;
c) de céder un proton;
d) d’accepter un électron;
Q7
Soit la réaction d’équation bilan.
2H20 = H3O++HO-
a) elle correspond à la réaction entre un acide et
une base;
b) la constante associée vaut 10-14 à 250C;
c) elle est appelée réaction d’autoprotolyse de
l’eau
d) elle n’a lieu que dans l’eau pure.