Chapitre
6 : réaction acido-basique, titrage
Une
solution d’éthanoate de sodium
N.B. : aucune réaction
chimique ne peut "a priori" être considérée comme totale
(quantitative). La température des solutions est de 25°C
dans tout l’exercice.
Donnée :
pKe = 14,0
L’éthanoate de sodium NaCH3COO est un solide blanc, soluble dans l’eau,
de masse molaire M = 82,0 g.mol–1. Sa
solution aqueuse contient, entre autres, les ions Na+ et CH3COO–.
I. On prépare 100 mL
d’une solution aqueuse, notée (S), d’éthanoate de sodium de concentration
C = 0,10 mol.L–1 à partir
du solide pur. On mesure le pH de la
solution (S) obtenue : pH = 8,9.
1.1.
Donner le
mode opératoire permettant de préparer (S), en précisant le matériel utilisé.
1.2.
Ecrire
l’équation de la réaction modélisant la transformation qui explique que (S)
soit basique.
1.3.
Donner
l’expression de son quotient de réaction QR.
1.4.
Calculer la
concentration [OH–] en ions hydroxyde dans (S).
1.5.
A l’aide d’un
tableau d’avancement, calculer l’avancement final xf
de cette réaction, et l’avancement maximal xm
si la réaction était totale (ou quantitative).
1.6.
En déduire le
taux d’avancement final t (exprimé en %). Conclure.
1.7.
Donner la
liste des espèces présentes dans (S). Quelles sont les deux espèces, à part
l’eau, dont la concentration est très nettement supérieure à celles des
autres ?
II. A V’=20 mL
de la solution (S) précédente, on ajoute V’’=5,0 mL
d’acide chlorhydrique de concentration C’ = 0,10 mol.L–1.
Le mélange a alors un
pH = 5,3.
2.1.
Ecrire l’équation
de la réaction modélisant cette transformation.
2.2.
Calculer la
quantité de matière no de CH3COO– initialement
présente dans les 20 mL et celle no’ de H3O+
apportée par les 5,0 mL. Quel réactif est en excès ?
2.3.
Calculer la
quantité de matière n’ de H3O+ dans le mélange,
lorsque l’équilibre est atteint.
2.4.
A l’aide d’un
tableau d’avancement, montrer que xf vaut environ 5.10–4 mol.
2.5.
En
déduire t .
Conclure.
2.6.
Calculer le pKa du couple auquel appartient CH3COO–
en utilisant les résultats obtenus à la question II.4.
III. Afin
de vérifier la concentration de la solution (S) (préparée partie I), on dose
20 mL de (S) par une solution titrée d’acide
chlorhydrique de concentration C’ = 0,100 mol.L–1.
On obtient le tableau de mesures suivant :
|
V(mL) |
0 |
0.2 |
0.5 |
1 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
15 |
16 |
17 |
18 |
18.5 |
18.8 |
19 |
19.2 |
19.5 |
20 |
20.5 |
21 |
22 |
23 |
25 |
|
pH |
8,9 |
6,8 |
6,3 |
6,0 |
5,7 |
5,4 |
5,1 |
4,9 |
4,7 |
4,6 |
4,35 |
4,2 |
4,1 |
3,9 |
3,6 |
3,4 |
3,2 |
3,05 |
2,9 |
2,7 |
2,55 |
2,4 |
2,3 |
2,1 |
2,0 |
1,9 |
On trace ensuite le graphe
pH = f(V) à l’aide d’un
logiciel (figure 1), puis on calcule l’opposé de la dérivée de pH par rapport à V (courbe notée « opdpH » sur la figure 2), et on trace les
deux courbes, en joignant les points.
N.B. : les valeurs en ordonnée de la courbe « –![]() = f(V) »
ne sont pas indiquées.
= f(V) »
ne sont pas indiquées.
Fig1

Fig2
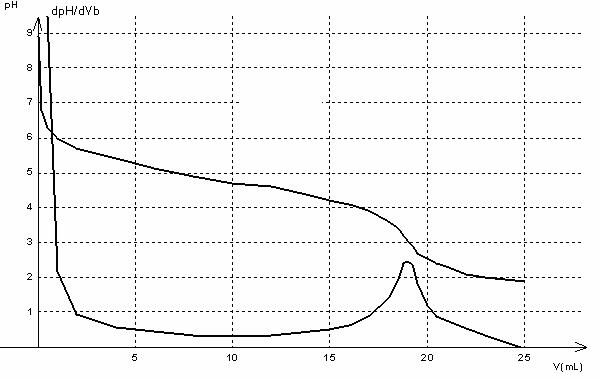
3.1.
Définir l’équivalence d’une réaction chimique
en général.
3.2.
Déterminer VE
le volume d’acide versé à l’équivalence, et pHE
la valeur du pH à l’équivalence. Expliquer brièvement votre méthode.
3.3.
En déduire la
véritable concentration de la solution C1 (S).
3.4.
Si la
solution (S) a bien été préparée comme à la question I.1., calculer le
« degré de pureté » des cristaux de NaCH3COO, c’est-à-dire
le rapport de la masse de NaCH3COO réellement contenu dans une masse
m de cristaux, sur la masse m des cristaux, exprimé en % .
3.5.
On donne les
couleurs et zones de virage de quelques indicateurs colorés acido-basique :
|
nom : |
couleur de la forme acide : |
zone de virage : |
couleur de la forme base : |
|
jaune d’alizarine |
Rouge |
2,1 - 3,4 |
jaune |
|
Hélianthine |
Rouge |
3,2 – 4,4 |
jaune |
|
vert de bromocrésol |
Jaune |
3,8 – 5,4 |
bleu |
|
bleu de bromothymol |
Jaune |
6,0 – 7,6 |
bleu |
|
phénolphtaléïne |
Incolore |
8,2 – 10,0 |
rose |
3.5.1.
lequel de ces indicateurs
colorés pourrait-on « a priori » utiliser pour effectuer un dosage sans
pH-mètre de (S) par l’acide chlorhydrique ?
3.5.2.
expliquer pourquoi le résultat
serait trop imprécis.