Chapitre 7 : effectuer des contrôles de qualité
Titrage des ions chlorure présents dans un anti-diarrhéique (2005 Polynésie)
Documents :
La
diarrhée entraîne une perte d'eau. Il faut empêcher cette perte hydrique par
des apports de
liquides.
L'eau
pure ne suffit pas. En effet, la déshydratation est le résultat non seulement
d'une perte en eau
mais aussi en électrolytes (sels minéraux: sodium, potassium, chlorure,
bicarbonates etc.). Il faut
donc apporter non seulement de l'eau mais aussi des électrolytes.
L'eau et les électrolytes vont empêcher la
déshydratation mais ne nourrissent pas l'enfant. Il a besoin d'énergie, de
calories. L'eau salée et sucrée est l'élément de base pour le réhydrater. L'O.
M. S. a mis au point une formule plus élaborée dont on trouve dans le commerce
plusieurs équivalents: Adiaril®,
GES 45®, etc...
L'Adiaril® est une préparation de régime pour
réhydrater les enfants en cas de diarrhée. Ce produit
ne contient ni lait, ni protéine de lait, ni gluten. On dilue chaque sachet de
7 g dans l'eau pour obtenir
200 mL de solution.
Composition de l’Adiaril® (extrait du tableau figurant sur la boite) :
|
|
Pour un sachet de 7 g (soit 200 mL de solution) |
|
Glucose |
2,65 g |
|
Saccharose |
2,49 g |
|
Sodium |
0,274 g |
|
Potassium |
0,156 g |
|
Chlorure |
0,210 g |
|
Citrate |
0,376 g |
|
Gluconate |
0,778 g |
I - PREMIERE PARTIE
Mise en évidence de la réaction support du titrage :
Dans un tube à essais A contenant V1 = 2,0 mL de solution
aqueuse de chlorure de sodium
(Na+(aq) + Cl–(aq)) de
concentration C1 = 5,00 x 10–2 mol.L-1, on ajoute V1
= 2,0 mL de solution
de nitrate d'argent (Ag+aq) + NO3–(aq))
de concentration C = 4,25 x 10-2 mol.L-1 et on observe
la formation d'un précipité blanc.
QUESTIONS
1. Écrire l'équation
de la seule réaction ayant lieu dans le tube à essais A.
2. Exprimer
littéralement le quotient de réaction Qr pour la réaction ainsi
écrite.
3. Calculer le
quotient de réaction Qr,i dans l'état initial fictif où les réactifs
seraient en
contact sans avoir réagi.
4. Sachant que la valeur
de la constante d'équilibre à 25°C est K = 6,4 x 109, commenter le
sens d'évolution de la transformation observée.
II - DEUXIEME PARTIE
On se propose de vérifier la masse d'ions chlorure dans un sachet.
Pour cela on décide de réaliser un titrage par conductimétrie. On
dissout un sachet
d'Adiaril® dans V = 200 mL d'eau. On prélève V2 = 20,0 mL de cette
solution (S) que l'on
place dans un bécher et on ajoute 200 mL d'eau distillée. On plonge dans le
milieu une cellule de
conductimétrie et on mesure la conductivité du mélange après chaque ajout de
solution de nitrate d'argent de concentration C = 4,25 x 10–2 mol.L-1. On obtient le
graphe donné en annexe 3 à rendre avec la copie.
1. A propos du
protocole :
1.1.
Quelle verrerie utiliseriez-vous pour préparer la solution de 200 mL
d'Adiaril® ?
1.2.
Quelle verrerie utiliseriez-vous pour prélever V2 = 20,0 mL
de solution ?
2. On donne les
conductivités ioniques molaires des ions présents dans la solution d'Adiaril® :
|
Ion |
Sodium |
Potassium |
Chlorure |
Citrate |
Gluconate |
Argent |
Nitrate |
|
Formule |
Na+ |
K+ |
Cl– |
Ci 3– |
gluc– |
Ag+ |
NO3– |
|
l conductivité ionique molaire en mS.m².mol-1 |
5,01 |
7,35 |
7,63 |
21,0 |
1,50 |
6, 19 |
7,14 |
Pendant le titrage on négligera les variations de volume de la solution.
2.1. Avant l'équivalence
a) Exprimer
littéralement la conductivité s1, du mélange.
b) Cette conductivité
peut aussi s'écrire sous la forme s1 = B + D1
avec B terme pratiquement constant et D1 terme variable au cours du
titrage.
Quels sont les ions
dont la conductivité participe à l'expression des termes B et D1 ?
c) En déduire que la
conductivité du mélange diminue faiblement avant l'équivalence.
2.2. Après l'équivalence
:
a) Exprimer
littéralement la conductivité s2 du mélange.
b) Cette conductivité
peut aussi s'écrire sous la forme s2 = B + D2
avec B
terme pratiquement constant et D2 terme
variable au cours du titrage.
Quels sont les ions dont la conductivité
participe à l'expression des termes B et D2 ?
c) En déduire que la
conductivité du mélange augmente nettement après l'équivalence.
3. Exploitation :
3.1
Déterminer sur le graphe donné en
annexe 3 le volume de la solution nitrate d'argent versé à l'équivalence.
3.2
En déduire la concentration des ions chlorure présents dans la solution
(S).
3.3
En déduire la masse mexp d'ions chlorure dans le sachet.
3.4
Comparer votre résultat à celui lu sur l'étiquette mlue en
calculant l'erreur relative.
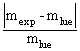
Donnée: Masse molaire atomique du chlore: 35,5
g.mol–1
ANNEXE 3 : A RENDRE AVEC LA COPIE
EXERCICE III :