Chapitre 7 : sens
d'évolution spontanée d'un système chimique
|
Soit
la réaction d'équation bilan : a.A + b.B = c.C + d.D Son quotient de réaction initial est noté Qr(i). Le sens direct correspond à l'écriture de gauche à droite de l'équation bilan. Pour déterminer
l'évolution spontanée du système, 3 cas peuvent se présenter : I) Qr(i) = K Si le quotient de
réaction initial est égal à la constante d'équilibre alors le système est
déjà en équilibre et n'évolue pas : les concentrations initiales en espèces
A, B ,C , D ne changent pas, l'avancement x de la réaction est nul. Si Qr(i) = K pas d'évolution. II) Qr(i) < K Lorsque le quotient de
réaction initiale Qr(i ) est inférieur à la constante d'équilibre K, alors le
système évolue dans le sens direct de l'écriture de l'équation de la réaction
jusqu'à l'équilibre. L'avancement de la réaction à l'équilibre xeq
est positif. |
Les
espèces A et B vont être consommées, les espèces C et D vont être produites. Si Qr(i) < K, réaction
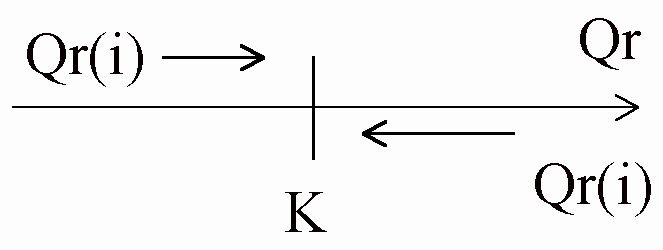
spontanée dans le sens direct III) Qr(i) > K Lorsque le quotient de
réaction initiale Qr(i) est supérieur à K, le système évolue dans le sens
inverse de l'écriture de l'équation de la réaction jusqu'à l'équilibre.
Si Qr(i) > K évolution
spontanée dans le sens inverse Conclusion : sens
d'évolution d'un système chimique
|