Une
solution d’éthanoate de sodium énoncé
NB :
Les concentrations molaires en solutés apportés sont notées C, celles à
l’équilibre [ ].
I.1
- On pèse m=CVM=0,82g de solide.
- On les introduit dans une fiole jaugée
de 100mL.
- On ajoute un peu d’eau distillée jusqu’à
dissolution complète du solide.
- On complète jusqu’au trait de jauge
- on bouche, puis on va au cinéma (bien
accompagné).
I.2 Vidéo
![]()
I.3
![]()
I.4
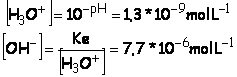
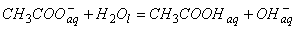 I.5
I.5
EI CV excès 0 0
EF CV-xf
excès xf xf
![]()
I.6
![]()
soit 7,7*10-3% d’ion éthanoate a
réagit.
La
transformation chimique est limitée.
I.7
Espèces présentes : CH3COO- ; CH3COOH ;
OH- ; H3O+ ; Na+ et H2O.
- il s’agit de CH3COO-
et de Na+ car la transformation chimique est limitée.
2.1 Vidéo
Equation
de la réaction :
![]()
2.2
![]()
Calcul du réactif en excès :
no-xmax = 0 donc xmax
= 2,0x10-3mol
n’o-xmax = 0 donc xmax = 5,0x10-4 mol
La plus grande valeur de xmax
correspond au réactif en excès :
CH3COO- est donc en excès.
2.3
Vidéo
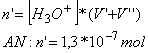
2.4 Vidéo
![]()
EI n0 n’0 0 excès
EF n0-xf n’= n’0-xf xf excès
Soit à l’équilibre (état final
EF) :
![]()
AN : xf=5,0*10-4
mol.
2.5
![]()
La transformation chimique est totale.
2.6
Vidéo
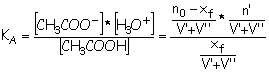
A.N : KA=1,6*10-5 d’où pKA= - logKA =
4,8.
3.1 L’équivalence est une notion théorique.
C’est l’instant où il n’y a plus aucun réactif dans le système réactionnel. On
dit que les réactifs ont été introduits dans les proportions stœchiométriques.
3.2 Méthode des tangentes ou (mieux) au
maximum de la courbe dérivée.
VE =19,1 mL .
pHE=3,1
3.3 A l’équivalence on a selon
l’équation de la réaction (voir cours) : C’VE= C1.V
avec V = 20mL
AN : pour VE =19,1 mL C1= 9,6*10-2molL-1
3.4 Vidéo
Soit m’ la masse d’éthanoate de sodium
contenu dans m=0,82g de cristaux.
![]()
(CH3COONa
s’est dissocié totalement dans l’eau pour former CH3COO-
et Na+)
dans les V = 100mL n(CH3CO2-) =
C1.V.= 9,6*10-3mol
Soit m’=
n(CH3CO2-) .M = 9,6x10-3x82 = 0,79 g.
Le degré P de pureté est donc :
P = (m’/m)x100
AN : P = 96% d’éthanoate de sodium.
3.5.a Il s’agit du jaune d’alizarine car pHE
est situé dans sa zone de virage. (Ce n’est pas une condition suffisante).
3.5.b L’autre condition est que le saut de
pH autour du point équivalent soit important, ce qui n’est pas le cas ici.