Dosage d'un vinaigre
Q1
a) Equation chimique associée à la transformation du système étudié :
CH3COOH(aq)
+ Na+(aq) + HO-(aq) = CH3COO-(aq)
+ H20(l) + Na+(aq)
b) Réponse partielle, pour voir la correction vidéo clique
ici.
Le quotient de réaction est :
![]()
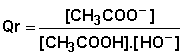
c) Réponse partielle, pour voir la correction vidéo clique
ici.
![]()
d) La constante d'équilibre ne dépend pas de la composition initiale du
système, mais uniquement de la température.
Pour que la réaction puisse servir de support au dosage, elle doit être
instantanée et quasi-totale.
Q2
a) Pour déterminer graphiquement les coordonnées du point d'équivalence,
on utilise la méthode des tangentes :
Méthode des
tangentes
1) Trace 2 tangentes à la courbe, parallèles entre elles, de part et
d'autre du point d'équivalence.
2) Trace la parallèle équidistante de ces deux
tangentes.
3) l'intersection de cette parallèle avec la
courbe pH = f(V2) donne le point d'équivalence E (V2E ; pHE ).
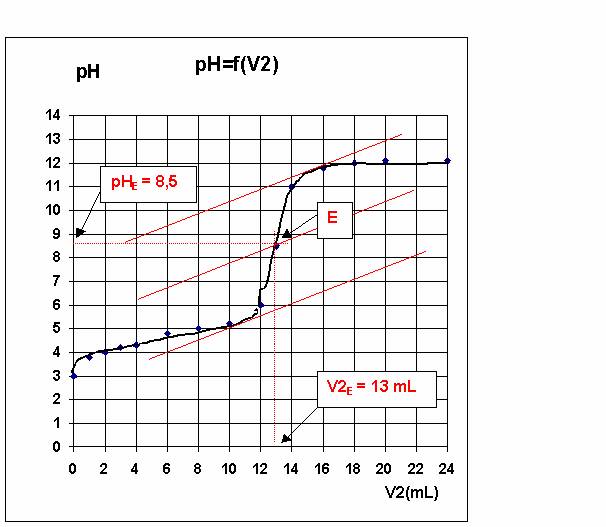
D'après la méthode des tangentes, le point de d'équivalence E a pour
coordonnées :
E ( V2E = 13 mL ; pHE = 8,5 )
b) Réponse partielle pour voir la correction vidéo clique
ici.
Espèces majoritaires à l'équivalence :
CH3CO2- , Na+ et l'éternel H20.
Q3
a) on
rappelle l'équation bilan de la réaction étudiée :
CH3COOH(aq) + Na+(aq)
+ HO-(aq) = CH3COO-(aq)
+ H20(l) + Na+(aq)
A l'équivalence les réactifs ont été introduits dans
les proportions stœchiométriques :
à l'équivalence :
![]()
b) On reprend la relation entre le nombre de moles à
l'équivalence :
![]()
c) Attention la solution que l'on a dosée, est une
solution diluée 10 fois de vinaigre. Par conséquent la concentration en acide
éthanoïque 'c ' du vinaigre est :
c = 10.c1 = 1,3 mol.L-1
Q4
a) Réponse partielle pour voir la correction vidéo clique
ici.
![]()
![]()
b) Réponse partielle pour voir la correction vidéo clique
ici.
Quantité d'acide éthanoïque restant dans le milieu
réactionnel : 6,5x10-4 mol.
Quantité d'ion éthanoate formé : 6,5x10-4
mol.
c) Réponse partielle pour voir la correction vidéo clique
ici.
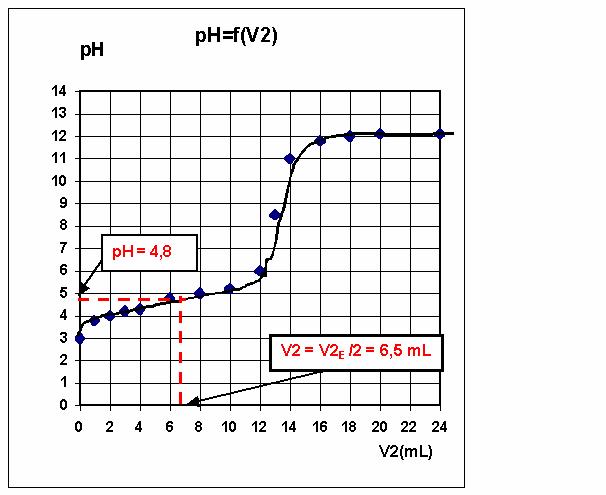
pH = 4,8
d) Lorsque V2 = V2E/2 = 6,5 mL, on
retrouve à partir de la courbe pH = 4,8.
Cette valeur est en accord avec celle trouvée
précédemment.
A la "demi-équivalence" le pH de la
solution est égal au pKa du couple CH3COOH / CH3CO2-.