Pile nickel argent (énoncé)
Q1
a) L'ion chlorure réagit avec l'ion argent pour donner un précipité de
chlorure d'argent !
Equation bilan :
Ag+aq + Cl-aq = AgCl(s)
Cette réaction, 'parasite' l'équation bilan de fonctionnement de la
pile. Pour l'éviter on prend des ions nitrate NO3-
à la place des ions chlorure Cl-.
b) Plaque B : Métal argent ; Plaque A : Métal nickel.
UBA = VB-VA > 0 .
Par conséquent :
VB > VA, la plaque d'argent a un potentiel
électrique plus élevé que la plaque de nickel.
Conclusion :La plaque
d'argent représente la borne positive de la pile, la plaque négative étant la
plaque de nickel.
Schéma conventionnel de la pile :
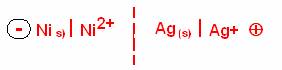
c) Toutes les
charges positives circulent dans le sens du courant électrique.
Les charges positives sont les cations Ag+ , K+, Ni2+
,et les ions oxonium (H3O+) ultra minoritaires
(concentration négligeable).
Toutes les charges négatives circulent dans le sens opposé au courant
électrique.
Les charges négatives sont :
1) Les électrons, dans les électrodes et les fils électriques.
2) Les anions NO3 -, SO42- et
les ions hydroxyde HO- (ultra minoritaires, donc de
concentration négligeable).
Q2
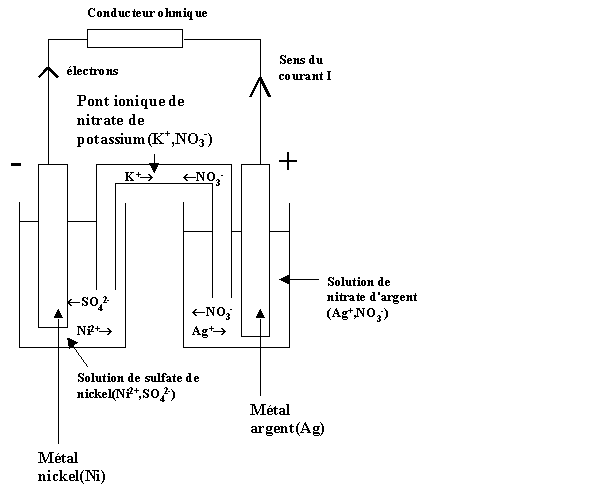
a) Schéma de la pile :
b) Réponse partielle, pour voir la vidéo clique ici.
Equation bilan de fonctionnement de la pile :
Ni(s) + 2 Ag+(aq)
= Ni2+(aq) + 2 Ag(s)
c) Réponse partielle, pour voir la vidéo clique ici.
Rôle du pont ionique :
1) Préserver l'électroneutralité des 2
solutions ioniques.
2) Assurer la conduction du courant
électrique entre les 2 solutions.
Q3
a) Attention, ne pas faire intervenir
les corps solides dans la constante d'équilibre. Ne pas oublier le coefficient
stœchiométrique '2' des ions argent : leur concentration est élevée au
carré !
Constante d'équilibre k :
Ni(s) + 2 Ag+(aq) = Ni2+(aq)
+ 2 Ag
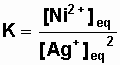
b) Quotient de réaction initial Qr(i) :
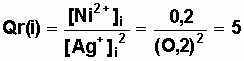
c) Le quotient de réaction initial est inférieur à la constante
d'équilibre Qri <<K
Par conséquent le sens d'évolution spontané de la réaction est dans le
sens direct de la réaction de fonctionnement de la pile (Ni + 2 Ag+ = Ni2+ +
2 Ag )
Pour plus d'information voir le chapitre sur le sens d'évolution spontané d'une
réaction.
Q4
a) Réponse partielle, pour voir la vidéo clique
ici.
Q = c.V.F = 1930 C
b) La capacité est égale au nombre d'électrons N
fournie par la pile, par la charge d'un électron.
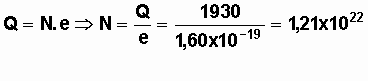
La pile peut fournir au maximum 1,21 x 1022 électrons
au circuit.
c) Réponse partielle, pour voir la vidéo clique
ici.
D mNi = - 0,587 g
Q5
a) Données: D t= 2h 30 min = 2 x 3600 + 30 x 60 = 9000 s ; I =
Quantité d'électricité
fournie par la pile : q(fournie) = I.D
t = 9000 x 0,01 =
La quantité
d'électricité q restante est égale à la capacité Q de la pile, moins la
quantité d'électricité fournie !
q =
Q-q(fournie) = 1930-90 =
La pile peut encore
fournir
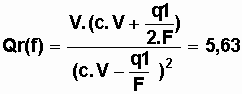
c) Qr(f)>Qr(i) (5,63 > 5) c'est tout à fait
logique puisqu'on a vu précédemment que la réaction avait lieu dans le sens
direct de la réaction. Au cours de la réaction la constante de réaction Qr va
augmenter jusqu'à atteindre la valeur K. La pile sera alors complètement
déchargée.