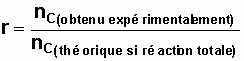Chapitre
10 : estérification hydrolyse (suite)
|
3)
Caractères hydrophile et lipophile des ions carboxylate Le groupe
carboxylate est polaire du fait de la différence d'électronégativité entre
l'oxygène et le carbone. Ce groupe s'entoure facilement de molécules d'eau
polaire. On dit qu'il est hydrophile (du grec hudor : eau et philos :
ami). Par contre il n'attire pas les chaînes carbonées présentes dans
les graisses car il y a très peu de différence d'électronégativité entre le
carbone et hydrogène : la liaison carbone hydrogène n'est pas polaire. Ce
groupe est lipophobe (du grec lipos : graisses et phobos : peur).
1) Influence de la
température L'augmentation
de température augmente la vitesse de la réaction d'estérification ou
d'hydrolyse, mais ne modifie pas leur rendement( car la
réaction est athermique). 2) Influence d'un
catalyseur Un
catalyseur permet d'atteindre plus rapidement l'état d'équilibre de la réaction d'estérification ou
d'hydrolyse, IV)
Amélioration du rendement d'une estérification 1) Rendement d'une
réaction Soit la
réaction suivante : a.A + b.B = c.C
|
2) Utilisation d'un
réactif en excès En augmentant l'excès
d'un des réactifs (acide ou alcool) de la réaction d'estérification, on augmente son rendement, et son taux d'avancement
final. 3) Elimination d'un
produit formé Une fois l'équilibre
d'estérification atteint, en éliminant l'ester ou l'eau formé(e), le quotient
de réaction devient inférieur à la constante d'équilibre K. Le système évolue à
nouveau dans le sens direct de la réaction d'estérification. Le rendement est amélioré car le nombre de mole
de réactif en défaut diminue. Pour éliminer
l'ester on
peut l'utiliser un montage de distillation
fractionnée. 4) Influence des réactifs Le rendement de la
réaction d'estérification ne dépend pratiquement pas de la nature de l'acide
carboxylique utilisé. Par contre il dépend de la
classe d'alcool utilisée. (67 % pour un alcool primaire, 60 % pour un
alcool secondaire, 5 % pour un alcool tertiaire. La constante
d'équilibre K d'une réaction d'estérification dépend de l'alcool utilisé. |